過氧化鋅
化合物
| 過氧化鋅 | |
|---|---|
| |
| 英文名 | Zinc peroxide |
| 別名 | 二氧化鋅 |
| 識別 | |
| CAS號 | 1314-22-3 |
| PubChem | 10129902 |
| EINECS | 215-226-7 |
| 性質 | |
| 化學式 | ZnO2 |
| 莫耳質量 | 97.408 g·mol⁻¹ |
| 外觀 | 白色至微黃色粉末 |
| 密度 | 1.57 g/cm3 |
| 熔點 | 212°C 分解 |
| pKa | ~7 (3%溶液) |
| 能隙 | 3.8 eV (間接) [1][2] eV |
| 結構 | |
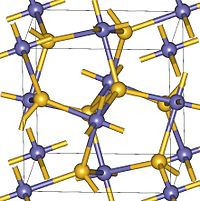
| 晶體結構 | 立方晶系 |
| 空間群 | Pa-3 |
| 危險性 | |
| 歐盟危險性符號 | |
| 警示術語 | R:R9 |
| 安全術語 | S:S17, S24/25, S27 |
| NFPA 704 | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
性質
編輯過氧化鋅是白色至微黃色的粉末,無臭無味。微溶於水,並水解為過氧化氫和氫氧化鋅。遇稀酸分解放出過氧化氫。pH 低於5時較易溶解。單獨受熱至150℃以上時迅速分解為氧化鋅和氧,但如果存在濕的有機物或過渡金屬如 或 時,在室溫或略高於室溫,過氧化鋅就會迅速分解。[3]
過氧化鋅是一種強氧化劑,與有機物接觸可以發生燃燒。商品一般為白色粉末,其中過氧化鋅和氧化鋅大約各占一半。
X射線結果表明過氧化鋅是一種真正的過氧化物, 與 離子排列成立方的黃鐵礦結構,Zn-O 鍵長 211±1 pm,O-O 鍵長 148±3 pm,體積模量 174 GPa,在 5K 以上呈順磁性。[4] 過氧化鋅晶體的鍵具有明顯的共價鍵性質。[3]
潮濕空氣中,加熱過氧化鋅至200℃會生成少量的超氧化鋅(Zn(O2)2)。產物超氧化鋅只有與過氧化鋅形成固熔體時才是穩定的。它的生成必定伴隨著陽離子空穴的生成。
製取
編輯不純的過氧化鋅可以從鋅鹽和過氧化氫的鹼性溶液中沉澱出來。更好的製備方法是用氧化鋅或二乙基鋅的乙醚溶液與濃的過氧化氫作用,此時生成化學式為 的化合物,推測它是鋅的一種氫氧混合衍生物。[2]
用途
編輯參考資料
編輯- ^ A.L. Companion. The diffuse reflectance spectra of zinc oxide and zinc peroxide. Journal of Physics and Chemistry of Solids. 1962, 23: 1685. doi:10.1016/0022-3697(62)90205-6.
- ^ 2.0 2.1 D. Sebőka, T. Szabóa and I. Dékány. Optical properties of zinc peroxide and zinc oxide multilayer nanohybrid films. Applied Surface Science. 2009, 255: 6953–6962. doi:10.1016/j.apsusc.2009.03.020.
- ^ 3.0 3.1 呂雲陽,王文紹,劉頌禹,季振平. 《无机化学丛书》第六卷:卤素、铜分族、锌分族. 北京: 科學出版社. 1995年12月: 719–720. ISBN 7-03-003647-6.
- ^ W. Chen; et al. Synthesis, Thermal Stability and Properties of ZnO2 Nanoparticles. J. Phys. Chem. C. 2009, 113: 1320. doi:10.1021/jp808714v.
- ^ Akiba, M.; and A. S. Hashim. Vulcanization and crosslinking in elastomers. Progress in Polymer Science. 1997, 22: 475–521. doi:10.1016/S0079-6700(96)00015-9.
- ^ R. Hagel, K. Redecher, Patent US4363679-A, 1981

