氧化鈉
化合物
氧化鈉,化學式Na2O,是鈉的正常氧化物,常溫下是白色固體。其性質極活潑,為鹼性氧化物,與水反應生成氫氧化鈉。在空氣中加熱能生成淺黃色的過氧化鈉。[1]
| 氧化鈉 | |
|---|---|

| |
| |

| |
| IUPAC名 Sodium oxide | |
| 識別 | |
| CAS號 | 1313-59-3 |
| PubChem | 73971 |
| SMILES |
|
| InChI |
|
| UN編號 | 1825 |
| EINECS | 215-208-9 |
| 性質 | |
| 化學式 | Na2O |
| 摩爾質量 | 61.979 g·mol⁻¹ |
| 外觀 | 白色固體 |
| 密度 | 2.27 g/cm3 |
| 熔點 | 1132 °C |
| 沸點 | 1950 °C 分解 |
| 溶解性(水) | 反應生成NaOH |
| 溶解性(其他溶劑) | 不可溶 |
| 結構 | |
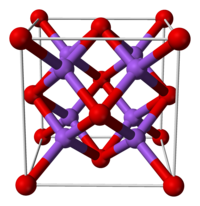
| 晶體結構 | 立方 |
| 配位幾何 | 八配位 |
| 危險性 | |
| 歐盟危險性符號 | |
| 警示術語 | R:R8-R14-R35 |
| 安全術語 | S:S8-S27-S39-S43-S45 |
| NFPA 704 | |
| 閃點 | 不可燃 |
| 相關物質 | |
| 其他陰離子 | 氫氧化鈉 硫化鈉 硒化鈉 碲化鈉 釙化鈉 |
| 其他陽離子 | 氧化鋰 氧化鉀 氧化銣 氧化銫 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
製備
編輯
氧化鈉也能直接藉由燃燒鈉而得,但是這樣會產生20%的過氧化鈉:
相關化學反應
編輯- 與水反應:
- 與酸反應:
- 與氧反應:
- 與二氧化碳反應:
參見
編輯- ^ Sodium Oxide (Na2O) - Structure, Physical Properties, Chemical Properties and Uses with FAQs of Sodium Oxide. BYJUS. [2023-07-12]. (原始內容存檔於2023-07-12) (英語).

