脑黏体虫
脑黏体虫(學名:Myxobolus cerebralis)是一种寄生于鲑科(包括鲑鱼、鳟鱼及其同类)的黏孢子虫,可以导致养殖及野生的鲑鱼和鳟鱼发生旋转病。大约一个世纪前,在德国的虹鳟上首次发现了脑黏体虫,但范围很快就扩大了并出现在欧洲的大多数国家(包括俄罗斯)、美国、南非[1]及其它国家。1980年代,研究发现脑黏体虫需要感染一种颤蚓科环节动物来完成其生命周期[2]。这一寄生虫利用刺丝囊胞的极丝刺入宿主细胞进行感染。
| 脑黏体虫 | |
|---|---|
| |
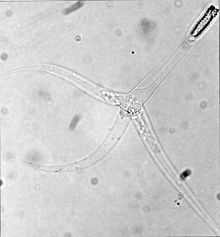
| 三角孢子虫期的脑黏体虫Myxobolus cerebralis。注意有三个“尾巴”。 | |
| 科学分类 | |
| 界: | 动物界 Animalia |
| 门: | 刺胞動物門 Cnidaria |
| 纲: | 黏孢子蟲綱 Myxosporea |
| 目: | 雙殼目 Bivalvulida |
| 科: | 碘泡虫科 Myxobolidae |
| 属: | 碘泡蟲屬 Myxobolus |
| 种: | 脑黏体虫 M. cerebralis
|
| 二名法 | |
| Myxobolus cerebralis Hofer, 1903
| |
| 異名 | |
| |
旋转病主要在幼鱼发病,并导致骨骼变形及损伤神经。发病的鱼以别扭的螺旋状向前“旋转”而不是正常地游动,同时也不容易找到饲料并容易被捕食。此病在幼鱼发病的致死率很高,感染的群体死亡率可高达90%,而存活的鱼也会因为残留在软骨及骨骼里的寄生虫而发生变形。這些魚形同寄生虫的储藏室,并不断向水中释放寄生虫而导致其它鱼死亡。脑黏体虫是致病性最高、对鱼类养殖业最有害的黏体动物之一。它是首个致病机理和症状都得到科学描述的黏孢子虫。[3]这一寄生虫不会传播给人。
分类学
编辑脑黏体虫的分类学和命名及归类到黏体动物亚门有着复杂的历史。最初认为这种寄生虫会感染鱼脑(因此使用了种名“脑”cerebralis),但是很快就在鱼的神经系统发现了这一寄生虫并发现其主要感染软骨及骨骼。曾有人试图将名称改为能更准确描述这一生物的“软骨黏体虫Myxobolus chondrophagus”,但由于命名法的规则而无法更名。[1]后来发现,先前称为Triactinomyxon dubium和T. gyrosalmo (放射孢子纲Class Actinosporea)的生物事实上是脑黏体虫的三角孢子虫期,同时也将脑黏体虫的生命周期扩展到三角孢子虫期。[4]同样,其它放射孢子纲也被列入各种不同黏孢子虫纲的生命周期。
今天,以前被认为是多细胞原生动物的黏体动物亚门也被许多科学家认为是动物,虽然它们的正式状态并没有改变。最近对分子领域的研究表明,这一类动物可能与两侧对称动物或刺胞动物门有关。刺胞动物门可能在形态学上更接近,因为这两类动物都有突出的极丝[5],但两侧对称动物在一些遗传学研究上可能更接近[6]。
形态学
编辑脑黏体虫M. cerebralis有着许多不同分期,从单细胞到相对大的孢子,但并不是全部都得到详细的研究。
三角孢子虫期(Triactinomyxon stage)
编辑这一阶段称为三角孢子虫triactinomyxon spores,可以感染鱼类,是一个约150微米(μm)长的单一类型。这一类型有三个突出或“尾巴”,每根“尾巴”的长度可达200微米。同时,这一类型的尾部有一个孢子原生质,孢子原生质含有64个生殖细胞并由细胞膜环绕[5]。另外还有三个极囊,每个极囊都包含一个170~180 μm长的盘绕的极丝[2]。这一阶段和黏孢子虫期的极丝(见上图)快速射入宿主的体内,并创造一个供孢子原生质进入的通道。
孢子原生质期(Sporoplasm stage)
编辑在接触鱼宿主并从极囊中发射出来后,孢子原生质被容纳在三角孢子虫进入上皮或肠道的中间“柱”。首先,孢子原生质经历了有丝分裂来生成更多的变形虫细胞。这些变形虫细胞可以进入更深的组织层,以便能到达脑软骨。[2]
黏孢子虫期(Myxosporean stage)
编辑通过鱼体内的孢子增殖期演化而来的黏孢子虫为晶体状。这些黏孢子虫的直径约为10微米并由六个细胞组成。其中的两个细胞形成极囊,两个合并形成双核的孢子原生质,另外两个形成保护瓣[5]。黏孢子虫可以感染寡毛纲动物,并可在消化的鱼软骨残余中找到。由于不同属之间形态学十分相似,一般很难将其与相关的品种区别开来。虽然脑黏体虫是唯一可以在鲑亚目软骨发现的黏孢子虫,其它外观相似的品种也可能在皮肤、神经系统和肌肉中存在。[2]
生命周期
编辑脑黏体虫有一个双宿主的生命周期,包括鲑鱼和颤蚓科环节动物。到目前为止,唯一已知会感染脑黏体虫的蠕虫是正颤蚓Tubifex tubifex[2],虽然目前科学家表明T. tubifex可能会指几个不同的品种[3]。首先,黏孢子虫被颤蚓科环节动物所消化。在蠕虫的肠道内腔,孢子会排出极囊并用极丝附在肠道上皮。壳瓣沿缝脊打开,双核生殖细胞则通过蠕虫肠道上皮细胞之间渗透进入。细胞进行繁殖,并通过无性细胞二分裂的无卵核受精过程产生出很多变形虫。在繁殖过程完成后,上皮细胞的胞间空隙超过了10个并排的蠕虫并可能被感染。[7]
感染后约60~90天,寄生虫经历了有性细胞阶段的孢子形成,并发展为泛孢子囊,其中每个都包含8个三角孢子虫期的孢子。这些孢子由寡毛纲动物的肛门排放入水中。[5]另外,鱼类也可能因为吃到感染的寡毛纲动物而感染。[5]已经感染的颤蚓会释放三角孢子虫至少1年。[7]三角孢子虫的孢子可以游在水中并通过皮肤感染鲑亚目动物。这些孢子进入鱼体内只需要几秒就已经足够。只要五分钟,生殖细胞称为孢子原生质的液囊就可以进行鱼的上皮细胞。而在一小时以内,孢子原生质就可以分裂成许多细胞在鱼体内传播。[5]
在鱼的体内,这种繁殖包括细胞内和细胞外的软骨内无性内生过程,也就是说新的细胞都从老细胞内生长而来。鱼体内的最后阶段是黏孢子虫,黏孢子虫是由孢子生殖形成。当鱼体腐烂或被吃掉后,它们就进入环境中。[5]最近的一些研究表明,一些鱼在存活时会排出仍存活的黏孢子虫。[8]
对于蠕虫而言,黏孢子虫是非常坚韧的:“脑黏体虫的胞子可以在零下20°C存活至少3个月,13°C的土壤中存活5个月,并可以通过白斑狗鱼Esox lucius或绿头鸭Anas platyrhynchos的肠道而不失感染性”[9]。三角孢子虫存活时间更短,根据温度的不同只能存活34天或更短时间[10]。
病理学
编辑脑黏体虫对多种鲑亚目鱼类的感染均有报道:其中有8种“大西洋”鲑亚目,斑鳟属;4种“太平洋”鲑亚目,太平洋鲑属;4种嘉鱼,红点鲑属;茴鱼,茴鱼属以及哲罗鱼,哲罗鲑属[11]。脑黏体虫会通过三角孢子虫的附着和不同阶段在组织、神经以及消化软骨内的迁移对其鱼宿主造成伤害。[5]鱼的尾巴会变黑,但除了软骨的病变外,通常内脏器官看起来都较健康。[2]其它症状包括幼鱼的骨骼变形及“旋转病”行为(追尾)。通常认为这些症状是由于推动平衡导致,实际是由于脊髓和低位脑干受损导致[3]。试验表明,鱼可以在皮肤上就杀死黏体虫(可能是抗生素的作用)。但是当它们进入中枢神经后,鱼就无法再对其进行攻击。不同品种之间的反应也并不相同[3]。
在正颤蚓T. tubifex,从消化壁释放的三角孢子虫会对蠕虫的黏膜造成伤害。这种情况会在同一条蠕虫上发生上千次,且一般认为这会影响营养吸收[5]。另外,被感染的蠕虫体重会降低并退色[3]。孢子几乎只在10°C~15°C体温之间时从蠕虫体内释放,所以生活在水温较高或较低环境中的鱼都不大容易被感染且感染率也存在一定的季节性[3]。
易感性
编辑鱼的大小、年龄、三角孢子虫的密度及水温都会影响鱼的感染率,而鱼品种的影响目前还不大确定[12]。由于5月龄以下的鱼骨骼还未完全成骨,这一阶段的鱼受到该疾病的影响也最大。这会导致幼鱼更可能感染并变形[13]并提供更多软骨来饲喂脑黏体虫。一个对7个品种不同品系的研究发现暴露两个小时后,溪红点鲑和虹鳟(一个品系除外)比其它品种更容易感染脑黏体虫,而公牛鳟、大鳞大麻哈鱼、河鳟和北极茴鱼则最不容易受到感染[12]。但河鳟可能会携带这种寄生虫。它们并不会表现出任何症状但却可能是脑黏体虫的原始宿主[14]。由于河鳟并不会表现出症状,所以直到外来的虹鳟被引进到欧洲才发现了这一寄生虫的存在[3]。不同鲑亚目的易感性都在鲑亚目对旋转病的易感性中列出。
诊断
编辑鱼类对于旋转病中度或严重的临床感染,可以根据初次感染35-80天后的行为及外观变化进行推理诊断。由于受伤及日粮中缺乏色氨酸和抗坏血酸也可以导致类似的情况,最终诊断应当以在鱼软骨内发现黏孢子虫为准[2]。在严重感染的情况下,应当对软骨进行显微检查并发现黏孢子虫[2]。在轻微感染的情况下,更常见的检测是在查找黏孢子虫前调查头软骨中胃蛋白酶和胰蛋白酶的消化情况(the pepsin-trypsin digest, PTD)。头部和其它组织可以用组织病理学做进一步检查并确认黏孢子虫的位置和形态是否符合脑黏体虫的特征。组织部分的胞子血清学鉴定也可以使用抗孢子的抗生素。寄生虫的鉴定可以用聚合酶链锁反应(PCR)对脑黏体虫415碱基对上18S rRNA基因进行扩增并确认[15]。初筛用的鱼应当处于最可能感染该寄生虫的生命阶段。已经暴发该寄生虫的国家都会定期使用这些技术进行检测,而一些国家(像澳大利亚和加拿大)并没有发生该寄生虫但可能因进口而危险到本地鱼群也会定期进行检测。
影响
编辑虽然最初在中欧的河鳟(Salmo trutta)和东北亚的其它鲑鱼上发现了野生病原,虹鳟(Oncorhynchus mykiss)对病原的传播却大大增加了这种寄生虫的影响。由于无法对脑黏体虫产生自然免疫,虹鳟特别易感并可以传播很多孢子给同地区的其它鱼类甚至是抗病品种,如河鳟,并因此携带过多寄生虫并导致大量死亡。在脑黏体虫暴发的地区,可能导致鱼群的大量减少甚至灭绝。[16][17]
在欧洲的影响
编辑由于这一物种已经成为欧洲的地方流行病并使鱼群得到免疫,脑黏体虫对欧洲的影响在某种程度上得到减轻。作为最易感的物种,虹鳟并非欧洲的本土鱼类。由于野生繁殖的鱼群很少,也很少有足够小的野生虹鳟会感染这种寄生虫。另一方面,它们广泛养殖于游钓水域及该寄生虫影响最大的水产业。欧洲设计用于防止虹鳟鱼苗受到感染的孵化及培育方法也被证明是成功的。这些技术包括在无孢子的水域进行孵化并在水箱或水道中培育鱼苗到成骨期。这些方法特别关注水源质量,以避免在换水时引入孢子[18]。在骨骼成骨并被认为可在临床上对此寄生虫产生抵抗力后,鱼苗才被移到地面池塘中。[13]
在新西兰的影响
编辑新西兰在1971年首次发现脑黏体虫。这种寄生虫只在远离多数水产养殖区的南岛的河流发现。另外,新西兰对鲑亚目的商业化养殖也很少感染旋转病,而且这种寄生虫也并没有感染这里的本地鲑亚目品种[19]。这种寄生虫存在的一个间接重要影响是对出口到澳大利亚鲑鱼产品的严格检疫。
在美国的影响
编辑1956年,宾夕法尼亚州由于从欧洲引进了已经感染的鳟鱼而将脑黏体虫引入,并传播至南部和西部地区。这也是脑黏体虫在北美首次得到报道[20]。直至1980年代,旋转病仍被认为是在孵化池虹鳟的管理问题所造成。但是最近在落基山脉诸州(科罗拉多州、怀俄明州、犹他州、蒙大纳州、爱达荷州及新墨西哥州)的天然水域也存在了该寄生虫,并在这里的一些游钓河流造成了较高死亡率。美国西部的一些河流甚至损失了90%的鳟鱼[21]。另外,旋转病也影响了在旅游业中相当重要的休闲游钓,这一行业在美国西部一些州份的经济中也占据了较大比重。例如,蒙大拿旋转病特别小组(Whirling Disease Task Force)估计鲑鱼相关休闲娱乐产业产生的消费仅在蒙大纳州就有300,000,000美元。[3]。更糟的是,一些脑黏体虫感染的鱼类(公牛鳟、山鳟及硬头鳟)已经受到威胁或濒临绝种[3]。科罗拉多州和蒙大纳州受到影响最为严重,而加利福尼亚州、密歇根州和纽约州受到的影响则最轻,具体的原因仍不清楚,但可能与环境条件有气候条件有关[22]。
防控措施
编辑一些生物学家试图在三角孢子虫成熟前将其灭活。在实验室里,目前只有强酸或强碱、中高浓度的盐类或电可以提前让极丝失活。而神经化学、刺细胞动物的化学致敏物质及鳟鱼黏膜均无效[23],同时也会令鱼受到麻醉或死亡[24]。如果孢子能得到灭活则无法感染鱼,但仍不清楚是否实验室的方法能否用于野生鱼类。
一些鱼的品系比其它鱼更具抗病力,甚至是同一品种的[12]。使用抗病品系可能会帮助减少水产养殖中旋转病的发病率及严重性。也有证明表明鱼群可在一定时间后自行产生抗病力[25]。另外,水产业也可以通过不使用地面池塘养殖幼鱼来避免感染脑黏体虫。这可以使幼鱼不会感染到颤蚓并更容易通过过滤、氯化及紫外消毒来消灭孢子和寡毛纲动物[2]。减少颤蚓群体的技术包括:定期对孵化池或养殖用池塘消毒,并在室内无病原的水中饲养小鳟鱼。光滑表面的混凝土或保持清洁的塑料水道及无污染的水可以保持养殖环境免受疾病影响[2]。
最后,一些药物如呋喃唑酮(痢特灵)、苯菌灵、烟曲霉素、氯胍和氯胺酮可以阻止孢子发育并减少感染率[2]。举个例子,有个研究表明给虹鳟Oncorhynchus mykiss饲喂烟曲霉素可以将受到感染的鱼总数从73%~100%减少至10%~20%[9]。不幸的是,这种治疗方法并不适用于野生鳟鱼[7],而且在美国食品药品监督管理局(FDA)批准进行的研究中也没有发现任何药物能有效治疗这一疾病[3]。
游钓人员可以透過以下方法避免传播这种寄生虫。
- 在不同地方钓鱼时应事先清洁钓具并不将鱼从一个水域带到另一水域,这样也能避免不同水道间的交叉污染。
- 孢子可以隐藏在毡底的涉水鞋下,需要用10%氯漂白剂和水进行消毒至少15分钟并彻底冲洗。
- 由于魚体中的孢子会释放到水中,鱼骨或内脏不能暴露在任何水体中。鲑鱼和鳟鱼不能用作诱饵。
参考文献及注释
编辑- ^ 1.0 1.1 Bartholomew, J.L.; Reno, P.W. The history and dissemination of whirling disease. American Fisheries Society Symposium. 2002, 29: 3–24 (英语).
- ^ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 Markiw, M.E. Salmonid Whirling disease. Fish and Wildlife Leaflet. 1992, 17: 1–3 [2017-03-08]. (原始内容存档于2011-05-27) (英语).
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 Gilbert, M. A. & Granath, W.O. Jr. (2003). Whirling disease and salmonid fish: life cycle, biology, and disease. Journal of Parasitology 89: 658–667.
- ^ Kent, M. L., Margolis, L. & Corliss, J.O. (1994). The demise of a class of protists: taxonomic and nomenclatural revisions proposed for the protist phylum Myxozoa Grasse, 1970. Canadian Journal of Zoology 508: 932–937.
- ^ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 5.7 5.8 Hedrick, R. P. & El–Matbouli, M. (2002). Recent advances with taxonomy, life cycle, and development of Myxobolus cerebralis in the fish and oligochaete hosts. American Fisheries Society Symposium 29: 45–53.
- ^ Monteiro, A. S., Okamura, B., and P. W. H. Holland. (2002). Orphan worm finds a home: Buddenbrockia is a Myxozoan. Molecular Biology and Evolution 19: 968–971. 存档副本. [2005-05-09]. (原始内容存档于2005-04-11).
- ^ 7.0 7.1 7.2 El-Matbouli, M., and Hoffmann, R.W. (1998). Light and electron microscopic studies on the chronological development of Myxobolus cerebralis to the Actinosporean stage in Tubifex Tubifes. International Journal For Parasitology 28: 195–217.
- ^ Nehring, R. B. Thompson, K. G. Taurman, K. A. & Shuler, D.L. (2002). Laboratory studies indicating that living brown trout Salmo trutta expel viable Myxobolus cerebralis myxospores. American Fisheries Society Symposium 29: 125–134.
- ^ 9.0 9.1 El-Matbouli, M., and Hoffmann, R.W. (1991). Effects of freezing, aging, and passage through the alimentary canal of predatory animals on the viability of Myxobolus cerebralis spores. Journal of Aquatic Animal Health 3: 260–262.
- ^ Markiw, M.E. (1992). Experimentally induced whirling disease. II. Determination of longevity of the infective triactinomyxon stage of Myxobolus cerebralis by vital staining. Journal of Aquatic Animal Health 4 (1): 44–47.
- ^ Lom, J. & Dyková, I. (1992). Protozoan Parasites of Fishes, Elsevier, Amsterdam. ISBN 0-444-89434-9.
- ^ 12.0 12.1 12.2 Vincent, E. R. (2002). Relative susceptibility of various salmonids to whirling disease with emphasis on rainbow and cutthroat trout.. American Fisheries Society Symposium 29: 109–115.
- ^ 13.0 13.1 Halliday, M.M. (1976). The Biology Of Myxosoma cerebralis: The Causative Organism Of Whirling Disease Of Salmonids. Journal of Fish Biology 9: 339–357.
- ^ Hoffmann, G. (1962). Whirling Disease Of Trout. U.S. Department Of The Interior, Fishery Leaflet 508: 1–3.
- ^ Andree, K.B., MacConnell, E. and Hedrick, R.P. (1998). A nested polymerase chain reaction for the detection of genomic DNA of Myxobolus cerebralis in rainbow trout Oncorhynchus mykiss. Diseases of Aquatic Organisms 34: 145–54.
- ^ Nehring, R.B. (1996). Whirling Disease In Feral Trout Populations In Colorado. In E.P. Bergersen And B.A.Knoph (eds.), Proceedings: Whirling Disease Workshop––where Do We Go From Here? Colorado Cooperative Fish And Wildlife Research Unit, Fort Collins.: pp.159.
- ^ Vincent, E.R. (1996). Whirling Disease—the Montana Experience, Madison River.. In, E.P. Bergersen And B.A.Knoph (eds.), Proceedings: Whirling Disease Workshop—where Do We Go From Here? Colorado Cooperative Fish And Wildlife Research Unit, Fort Collins.: pp.159.
- ^ Ghittino, P. (1970). Present Status Of Whirling Disease In Italian Trout Farms. Riv. It. Piscic. Ittiopat 5: 89–92.
- ^ Stone M A B, MacDiarmid S C, Pharo H J. (1997). Import health risk analysis: salmonids for human consumption. Ministry of Agriculture Regulatory Authority, New Zealand.[1] (页面存档备份,存于互联网档案馆)
- ^ Bergersen, E.P., and Anderson, D.E. (1997). The distribution and spread of Myxobolus cerebralis in the United States. Fisheries 22 (8): 6–7.
- ^ Tennyson, J. Anacker, T. & Higgins, S. (January 13, 1997). Scientific breakthrough helps combat trout disease. U.S. Fish and Wildlife Service Whirling Disease Foundation News Release.存档副本. [2006-01-03]. (原始内容存档于2005-06-16).
- ^ Wisconsin Department of Agriculture, Trade and Consumer Protection. Division of Animal Health. (October 2001). "Fish Health Advisory: Whirling Disease in Trout." 存档副本 (PDF). [2005-05-17]. (原始内容 (PDF)存档于2004-06-26). (.pdf).
- ^ Wagner, E. J. Cannon, Q. Smith, M. Hillyard, R. & Arndt, R. (2002). Extrusion of Polar Filaments of the Myxobolus cerebralis Triactinomyxon by salts, electricity, and other agents. American Fisheries Society Symposium 29: 61–76.
- ^ El-Matbouli, M., Hoffmann, R.W., Shoel, H., McDowell, T. S., & Hedrick, R.P. (1999). Whirling disease: host specificity and interaction between the actinosporean stage of Myxobolus cerebralis and rainbow trout (Oncorhynchus mykiss) cartilage. Diseases of Aquatic Organisms 35: 1–12.
- ^ Whirling Disease Foundation News. July, 2003. Research on whirling disease resistant rainbow trout 互联网档案馆的存檔,存档日期2007-07-31.