諾氏瘧原蟲
諾氏瘧原蟲(Plasmodium knowlesi,可縮寫為P. knowlesi)又稱猴瘧蟲,是一種常見於東南亞的靈長類瘧原蟲[1]。它能在食蟹猴體內引起瘧疾,但它也可能自然或人為地感染人類。
| 諾氏瘧原蟲 | |
|---|---|
| |
| 科學分類 | |
| 演化支: | SAR 超類群 SAR |
| 演化支: | 囊泡蟲類 Alveolata |
| 門: | 粘孢子總門 Myzozoa |
| 綱: | 無類錐體綱 Aconoidasida |
| 目: | 血孢子蟲目 Haemosporida |
| 科: | 瘧原蟲科 Plasmodiidae |
| 屬: | 瘧原蟲屬 Plasmodium |
| 種: | 諾氏瘧原蟲 P. knowlesi
|
| 二名法 | |
| Plasmodium knowlesi Sinton and Mulligan 1933
| |
由於卵形瘧原蟲(Plasmodium ovale ) 後來被分為兩個亞種,但由於亞種還未到種階,所以在主要的人類瘧原蟲中,諾氏瘧原蟲目前依然為第五種被發現的瘧原蟲。它可能會引發嚴重的瘧疾,其無性繁殖的紅血球內期約為24小時,患者通常會伴有周期性的間歇性寒熱發作。[2][3][4]這是人類於1965年首次發現的新型傳染病[2],在東南亞某些地區確診的瘧疾病例中,有70%的患者是被這種瘧原蟲感染[5]。諾氏瘧原蟲由瘧蚊叮咬傳播,[5]它嚴重影響了疫區居民的健康、當地經濟的發展與社會的穩定。
發現史
編輯諾氏瘧原蟲是由義大利寄生蟲學家朱塞佩·弗蘭奇尼於1927年在觀察食蟹猴血液標本時首次發現的。他當時指出了諾氏瘧原蟲不同於食蟹猴瘧原蟲(Plasmodium cynomolgi )和豬尾猴瘧原蟲(Plasmodium inui )[6]。後來,坎貝爾在位於印度加爾各答的英國皇家熱帶醫學與衛生學院工作時,於1931年從由新加坡進口的長尾獼猴體內也發現了這種瘧原蟲。坎貝爾當時在L.E.納皮爾手下工作,並在研究由另一種原蟲引發的傳染病——黑熱病(內臟利什曼病)。納皮爾給三種猴子接種了瘧原蟲菌株,其中,在被接種的恆河猴(Macaca mulatta )種群中引發了暴發性的感染。納皮爾當時得知了微生物部門也在尋找引起獼猴患病的瘧原蟲菌株,於是就將最先被接種瘧原蟲菌株的獼猴交給了羅伯特·諾爾斯博士的助手B·莫罕達斯·古普塔。古普塔博士在諾爾斯博士休假回來之前通過連續傳代維持了該種群的繁衍。1932年,諾爾斯和達斯·古普塔首次詳細地描述了該瘧原蟲物種,並表示它可以通過血液傳播給人類,但沒有為其正式命名。其後,辛頓(Sinton)和穆里根(Mulligan)將其正式命名為諾氏瘧原蟲(Plasmodium knowlesi )。在20世紀30年代早期到1955年,醫學界還曾廣泛採用給晚期梅毒(神經性梅毒)患者注射諾氏瘧原蟲菌株的方法以阻斷梅毒螺旋體在神經中的推進過程。[7]因為間日瘧原蟲或諾氏瘧原蟲引起人體三輪或者四輪高燒後,就會對密螺旋體帶來近乎致命的打擊,而梅毒螺旋體屬於密螺旋體的一種。[8][9][10]
1957年,加納姆等人[11]提出:諾氏瘧原蟲可能是第五種能夠引起人類地方性瘧疾的物種。
1960年,美國寄生蟲學家唐·E·艾爾斯(英語:Don E. Eyles)和他的導師G·羅伯特·科特尼(英語:G. Robert Coatney,1902-1990)在美國國立衛生研究院的孟菲斯實驗室對恆河猴進行了實驗,他們假設人類並不會感染「猴瘧」,因為早期的研究已經得出結論,獼猴不能寄生間日瘧原蟲。而間日瘧原蟲是一種人類瘧原蟲。這使得艾爾斯和科特尼開始研究食蟹猴瘧原蟲,這是一種與間日瘧原蟲非常相似的寄生蟲,可以模擬人類瘧疾感染。實驗中,這兩位研究人員將自己暴露在感染環境之中,對叮咬所引起的瘙癢並不在意;然而,艾爾斯在實驗後不久就發燒了。直到幾天後,兩人才懷疑艾爾斯可能已經感染了瘧疾。後來經過對血塗片的檢查證實,人類實際上是有可能感染「猴瘧」的。[12]
1965年,一名在美國陸軍地圖服務處擔任調查員的37歲男子,報告了首例自然發生的人類感染諾氏瘧原蟲病例。他曾在馬來西亞半島有過短暫旅行,之後前往泰國並在當地感到不適後就醫。[12]最初,其所被鑑定為感染了惡性瘧原蟲,但在一天後又被鑑定為三日瘧原蟲,直到用感染的血液接種給了恆河猴後才被確認為諾氏瘧原蟲。[8]在觀察發生感染時,G·羅伯特·科特尼博士和其他研究人員發現,當地人群經常會接觸到這種寄生蟲。而且,他們和當地的猴子群體是該寄生蟲的聯合宿主。觀察到這一結果的科特尼宣布:「猴瘧」是一種「真正的人畜共患疾病」。在該名調查員接受治療之前,科特尼將其血液樣本送回他在亞特蘭大的實驗室,在那裡,這些血液將會被用來感染監獄中的志願囚犯和恆河猴。[12]第二份關於自然感染諾氏瘧原蟲的報告出現在1971年。報告中指出:有一名馬來西亞男子自然感染了諾氏瘧原蟲,因此獲得了在馬來西亞婆羅洲沙撈越加帛區有人類感染諾氏瘧原蟲的這一重大進展。[8]如今,得益於分子檢測實驗的不斷發展,目前已經可以區分諾氏瘧原蟲和與其形態相似的三日瘧原蟲。自2004年以來,在東南亞各國,包括馬來西亞、泰國、新加坡、菲律賓、越南、緬甸和印度尼西亞,有關於人感染諾氏瘧原蟲的報告逐漸增多。[13]
經過對檔案樣本的研究表明,這種寄生蟲至少在上世紀90年代以來,就在馬來西亞發生過感染。[14]目前已知在沙撈越的某些地區,70%的瘧疾病例是由這種寄生蟲引起的。[15]
進化史
編輯基於貝葉斯聚類算法,諾氏瘧原蟲最可能的進化時間是25.7萬年前(95%最高后密度區間(HPD)為:9.8 - 47.8萬年前)。[16]雅各布和他的同事利用進化算法入侵檢測分析計算了自然宿主從長尾獼猴向人類轉移的可能性,並證明了相對宿主密度和個體層面上蚊子捕食偏好是如何影響這種轉移的。[17]
生活史
編輯諾氏瘧原蟲寄生蟲能夠在24小時內複製並完成其血液循環周期[4],這使得其可以在非常短的時間內產生相當高的寄生蟲密度負荷。因此,如果未對此進行治療,將會導致其發展成為一種非常嚴重的潛在疾病。其生命周期:裂殖子→營養體→裂殖體→裂殖子。處於這些階段的諾氏瘧原蟲在顯微鏡中與三日瘧原蟲難以區分,早期營養體與惡性瘧原蟲相同。
蚊蟲體內:[18]蚊子吞食哺乳動物宿主體內形成的配子細胞。它們要麼是小配子細胞(雄性配子細胞)要麼是大配子細胞(雌性配子細胞)。這些配子細胞分別發育成小配子和大配子,然後在蚊子的中腸內受精形成受精卵。受精卵成熟為卵母細胞,然後發育成卵囊。最後,卵囊發育成熟,釋放出子孢子,進入蚊子的唾液腺。
摘要:配子體→(小配子或大配子)→受精卵→卵母細胞 →卵囊→子孢子。
人體中: 紅血球外期(肝臟中):[18]蚊子叮咬人體後,將孢子體注入人體,通過血流進入肝臟,經過無性繁殖,並通過肝細胞分裂形成裂殖體。目前還沒有在肝臟中發現休眠子[19]。
摘要:子孢子→裂殖體→裂殖子。
人體中:紅血球內期(血液中):[18]裂殖子釋放到血液中,感染構成紅血球的一個無性循環。在紅血球內,一些裂殖子發育為滋養體,滋養體又發育為分裂體,分裂後釋放裂殖子,而另一些則發育為小配子細胞或大配子細胞。這些配子細胞留在血液中,蚊子可以將其吞下。
摘要:裂殖子→營養體→裂殖體→裂殖子。
傳染史
編輯諾氏瘧原蟲通常被認為是長尾獼猴和豬尾獼猴[13][20]的寄生蟲,但在森林邊緣工作或進入雨林工作的人類也有感染的風險。隨著東南亞的森林砍伐和加快發展的日益流行,人類現在正與許多獼猴有著密切和直接的接觸。[13]因此,越來越多生活在城市邊緣地區的人被發現感染了諾氏瘧疾。2014年,馬來西亞便報告了2,584例這種類型的瘧疾。[21]
這種寄生蟲主要出現在東南亞國家和地區,婆羅洲、柬埔寨、[22]馬來西亞、緬甸、菲律賓、新加坡[23]、泰國[24]和鄰近國家。而且據報道,這種寄生蟲似乎出現在沒有其他四種人類瘧疾的地區。受感染的蚊子僅限於森林地區。非傳染性蚊子通常出現在城市地區,但由於該地區蚊子數量眾多,還是可能會發生傳播。[2][25]特別是馬來西亞[8],但泰緬邊境也有相關的報道。[3]馬來西亞婆羅洲沙撈越地區確診的瘧疾病例中,有五分之一是由諾氏瘧原蟲引起的。[8]
諾氏瘧原蟲在非洲並不存在。這可能是因為非洲既沒有長尾獼猴,也沒有豬尾獼猴(二者均為諾氏瘧原蟲的宿主),而且許多西非人缺乏達菲抗原——這是該寄生蟲用來入侵紅血球表面的一種蛋白質。
傳播媒介
編輯諾氏瘧原蟲理論上有四種傳播模式:從受感染的蚊子到另一隻猴子,從受感染的猴子到人,從受感染的人到另一個人,再從受感染的人回到猴子。[13]在實際中,人類瘧疾似乎幾乎完全是由於猴子對人類的傳播。
已知載體為:按蚊屬、塞利氏蚊組亞屬、新邁蚊系、白踝按蚊組[4]這一群體的蚊子通常出現在東南亞的森林地區,但隨著森林地區越來越多地被用於耕田,人類正越來越多地接觸這些媒介。
在馬來西亞半島的猴群中,哈克里按蚊被認為是諾氏瘧原蟲的主要傳播媒介。但是,雖然哈克里按蚊(Anopheles hackeri)能夠將瘧疾傳播給人類,[27]但人類對其並沒有吸引力,似乎也不太可能成為傳播給人類的重要媒介。[28]
獼猴和人類都有吸引力對按蚊(Anopheles latens)均有吸引力,並已被證明是在馬來西亞婆羅洲沙羅越加帛區向人類傳播諾氏瘧原蟲的主要媒介。[29]
據報道,按蚊(Anopheles cracens)也是諾氏瘧原蟲的載體。兩種蚊子均屬於白踝按蚊種群,都被證明含有多達1,000個子孢子,這表明它們可能是有效的載體。[13]
臨床
編輯目前已經提出了兩種可能的人類傳播模式:一種是從受感染的猴子傳染給人類,另一種是從受感染的人傳染給另一個人。
症狀通常在被感染的蚊子咬人後大約11天開始出現,感染後10-12天可在血液中看到寄生蟲。[31]寄生蟲可能迅速繁殖,導致非常高的寄生蟲密度,如此將可能出現生命風險。[31]
雖然目前諾氏瘧原蟲的感染率相對較低,但它帶來的一個風險是在使用顯微鏡時與其他形式的瘧疾寄生蟲(如P. malariae)弄混導致誤診。諾氏瘧原蟲只有通過PCR和/或分子鑑定才能準確地與瘧原蟲區分開來。
諾氏瘧原蟲在人類身上的症狀包括頭痛、發燒、發冷和出冷汗。[31]辛格等人(2004)[8]在馬來西亞婆羅洲沙羅越卡皮特醫院發現94例單種諾氏瘧原蟲感染患者出現臨床症狀。症狀包括:100%的患者出現發燒,發冷和僵直、32%的患者出現頭痛、18%的患者出現咳嗽、16%的患者出現嘔吐、6%的患者出現噁心、4%的患者出現腹瀉。這種寄生蟲在人類及其自然宿主獼猴體內的無性繁殖周期約為24小時.[2][3][4]因此,這種疾病可以與間日瘧和三日瘧[18]一起命名稱為日常瘧疾[2]。除了使用PCR分析進行實驗室診斷外,諾氏瘧原蟲自身也可能出現c反應蛋白水平升高和血小板減少。
由於這種寄生蟲在其紅血球外期階段缺乏休眠子[32],進而導致瘧疾不會復發[33]。
雖然這種微生物的感染通常並不嚴重,但在少數病例中可能發生危及生命的併發症甚至死亡。最常見的併發症是呼吸窘迫、肝功能異常,包括黃疸和腎功能衰竭。一組病例的死亡率約為2%。[15]
診斷
編輯諾氏瘧原蟲感染的診斷方法與其他瘧疾一樣,採用厚薄血膜塗片檢查法。諾氏瘧原蟲的外觀類似於三日瘧原蟲,除非在瘧疾參考實驗室中使用分子檢測方法[8],否則很難正確診斷。
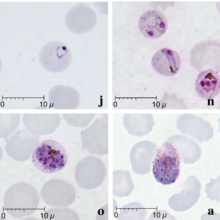
諾氏瘧原蟲的形態與三日瘧原蟲相似。瘧疾的特點是寄生蟲密集(所有階段),不會改變宿主紅血球的形狀或大小,也不會引起紅血球的增大。有時可觀察到橫跨紅血球的細長滋養體,稱為條帶型。裂殖子通常有8-10個裂殖子,通常呈蓮座狀排列,中間有一團色素。[34]
由於諾氏瘧原蟲的特異性,快速診斷測試試劑盒不一定能夠識別。
目前,聚合酶鏈式反應(PCR)檢測和分子鑑定是檢測和診斷諾氏瘧原蟲感染最可靠的方法。PCR能夠鑑定寄生蟲的DNA,但該技術鑑定速度較慢,無法用於常規鑑定。此外,PCR也很昂貴,需要非常專業的設備。[8]
治療
編輯由於諾氏瘧原蟲只需要24小時就能完成其紅血球周期,因此當它進入人體血液後可以迅速導致嚴重的寄生蟲血症,並帶來致命的後果。如同感染惡性瘧疾一樣,任何病情嚴重和迅速惡化的人都接受緊急和積極地治療。[4]
氯喹和伯氨喹對諾氏瘧原蟲有較好的療效。在一項治療的臨床研究中發現,採用口服氯喹三天後連續兩天24小時口服伯氨喹[35]的治療方法後對寄生蟲的清除反應迅速,平均時間為3小時。而間日瘧原蟲需要6至7小時才能清除。
公共衛生、預防策略和疫苗
編輯病理
編輯迄今為止,僅一例關於感染諾氏瘧原蟲的驗屍報告。其報告描述為[36]:男性患者,暴露10天後出現不適。四天後前往醫院就診,身體嚴重不適。他的嗜酸性粒細胞計數升高,血小板減少,低鈉血症,尿素、鉀、乳酸脫氫酶和氨基轉移酶值升高。曾有人懷疑是登革熱,但經過調查後排除了這種可能性。血液抹片上可見瘧原蟲,經PCR鑑定為諾氏瘧原蟲。屍檢肝脾腫大。大腦與心內膜表現為多發瘀點出血,肺部特徵與急性呼吸窘迫症候群一致。組織學檢查顯示,在大腦及其他任何器官均沒有慢性炎症反應的情況下,大腦、小腦、心臟和腎臟的血管內,色素被寄生的紅血球所隔離。脾臟和肝臟中含有豐富的巨噬細胞和寄生的紅血球。腎臟有急性腎小管壞死的證據。心臟切片中的內皮細胞明顯。腦切片對細胞內粘附分子-1呈陰性。
驗屍報告的總體情況與惡性瘧原蟲的情況非常相似。雖然都有腦部有出血和寄生蟲隔離的現象,但仍有重要的差異,如患者並沒有昏迷。
注釋
編輯加納姆曾在1963年對已知的諾氏瘧原蟲兩個亞種——P. knowlesi edesoni和P. knowlesi knowlesi有過描述。[37]其以寄生蟲學家J F B Edeson的名字進行命名。目前尚不清楚這兩個亞種之間是否存在臨床差異。
相關網頁連結
編輯- 1. 疾病預防控制中心:cdc.gov/malaria,https://www.cdc.gov/EID/content/14/11/1750.htm(頁面存檔備份,存於網際網路檔案館)
- 2. 世界衛生組織:http://www.who.int/topics/malaria/en/(頁面存檔備份,存於網際網路檔案館)
- 3. 關於發現諾氏瘧原蟲在人類瘧疾中作用的短片:http://www.abc.net.au/catalyst/stories/2533454.htm(頁面存檔備份,存於網際網路檔案館)
諾氏瘧原蟲基因組數據
編輯參考來源
編輯- ^ Perkins, Susan L.; Jos. J. Schall. A molecular phylogeny of malarial parasites recovered from cytochrome b gene sequences. Journal of Parasitology. 2002, 88 (2): 972–978. PMID 12435139. doi:10.1645/0022-3395(2002)088[0972:AMPOMP]2.0.CO;2.
- ^ 2.0 2.1 2.2 2.3 2.4 Chin W, Contacos PG, Coatney RG, Kimbal HR. A naturally acquired quotidian-type malaria in man transferable to monkeys. Science. 1965, 149 (3686): 865. PMID 14332847. doi:10.1126/science.149.3686.865.
- ^ 3.0 3.1 3.2 Jongwutiwes S, Putaporntip C, Iwasaki T, Sata T, Kanbara H. Naturally acquired Plasmodium knowlesi malaria in human, Thailand. Emerg. Infect. Dis. 2004, 10 (12): 2211–3. PMC 3323387 . PMID 15663864. doi:10.3201/eid1012.040293.
- ^ 4.0 4.1 4.2 4.3 4.4 Cox-Singh J, Davis TM, Lee KS, Shamsul SS, Matusop A, Ratnam S, Rahman HA, Conway DJ, Singh B. Plasmodium knowlesi malaria in humans is widely distributed and potentially life-threatening. Clin. Infect. Dis. 2008, 46 (2): 165–171. PMC 2533694 . PMID 18171245. doi:10.1086/524888.
- ^ 5.0 5.1 McCutchan TF, Piper RC, Makler MT. Use of Malaria Rapid Diagnostic Test to Identify Plasmodium knowlesi Infection. Emerg Infect Dis. 2008, 14 (11): 1750–1752. PMC 2630758 . PMID 18976561. doi:10.3201/eid1411.080840.
- ^ Franchini G (1027) Su di un plasmodio pigmentato di una scimmia. Arch Ital Sci Med Colon 8:187–90
- ^ 以毒攻毒以病克病!用疟原虫治癌症原来“有戏”. news.china.com. [2018-11-29]. (原始內容存檔於2018-12-06).
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 Singh B, Lee KS, Matusop A, Radhakrishnan A, Shamsul SS, Cox-Singh J, Thomas A, Conway DJ. A large focus of naturally acquired Plasmodium knowlesi infections in human beings. Lancet. 2004, 363 (9414): 1017–24. PMID 15051281. doi:10.1016/S0140-6736(04)15836-4.
- ^ 《致命接触》的笔记-第三章 疟疾. book.douban.com. [2018-11-29]. (原始內容存檔於2018-12-06).
- ^ 【南方都市报】以毒攻毒 用疟原虫治癌症“有戏”. www.gibh.cas.cn. [2018-11-29]. (原始內容存檔於2018-12-06).
- ^ Garnham PC, Lainson R, Cooper W. The tissue stages and sporogony of Plasmodium knowlesi. Trans R Soc Trop Med Hyg. 1957, 51 (5): 384–396. PMID 13467997. doi:10.1016/0035-9203(57)90071-8.
- ^ 12.0 12.1 12.2 Mason Dentinger, Rachel. Patterns of Infection and Patterns of Evolution: How a Malaria Parasite Brought "Monkeys and Man" Closer Together in the 1960s. Journal of the History of Biology. 2015-08-26, 49 (2): 359–395. PMID 26307748. doi:10.1007/s10739-015-9421-8.
- ^ 13.0 13.1 13.2 13.3 13.4 Vythilingam I, Noorazian YM, Huat TC, Jiram AI, Yusri YM, Azahari AH, Norparina I, Noorrain A, Lokmanhakim S. Plasmodium knowlesi in humans, macaques and mosquitoes in peninsular Malaysia. Parasit Vectors. 2008, 1 (1): 26. PMC 2531168 . PMID 18710577. doi:10.1186/1756-3305-1-26.
- ^ Lee K.S.; Cox-Singh J.; Brooke G.; Matusop A.; Singh B. Plasmodium knowlesi from archival blood films: Further evidence that human infections are widely distributed and not newly emergent in Malaysian Borneo. Int J Parasitol. 2009, 39 (10): 1125–1128. PMC 2722692 . PMID 19358848. doi:10.1016/j.ijpara.2009.03.003.
- ^ 15.0 15.1 Daneshvar C., Davis T.M.E., Cox‐Singh J., et al. Clinical and Laboratory Features of Human Plasmodium knowlesi Infection. Clin Infect Dis. 2009, 49 (6): 852–860. PMC 2843824 . PMID 19635025. doi:10.1086/605439.
- ^ Lee KS, Divis PC, Zakaria SK, Matusop A, Julin RA, Conway DJ, Cox-Singh J, Singh B. Kazura JW , 編. Plasmodium knowlesi: Reservoir Hosts and Tracking the Emergence in Humans and Macaques. PLoS Pathog. 2011, 7 (4): e1002015. PMC 3072369 . PMID 21490952. doi:10.1371/journal.ppat.1002015.
- ^ Yakob, L.; Bonsall, M.B.; Yan, G. Modelling knowlesi malaria transmission in humans: vector preference and host competence. Malaria Journal. 2010, 9: e329. PMC 2996403 . PMID 21080968. doi:10.1186/1475-2875-9-329.
- ^ 18.0 18.1 18.2 18.3 Manson-Bahr PEC, Bell DR, eds. (1987). Manson's Tropical Diseases. London: Bailliere Tindall, ISBN 0-7020-1187-8.
- ^ Markus, MB. Malaria: Origin of the Term "Hypnozoite". Journal of the History of Biology. 2011, 44 (4): 781–786. PMID 20665090. doi:10.1007/s10739-010-9239-3.
- ^ Ng O.T.; Ooi E.E.; Lee C.C.; Lee P.J.; Ng L.C.; Pei S.W.; Tu T.M.; Loh J.P.; Leo Y.S. Naturally Acquired Human Plasmodium knowlesi Infection, Singapore. Emerg. Infect. Dis. 2008, 14 (5): 814–816. PMC 2600232 . PMID 18439370. doi:10.3201/eid1405.070863.
- ^ Malaysia: Dengue cases top 45,000, 'monkey malaria' accounts for majority of human malaria cases. 2015-05-25 [2018-11-19]. (原始內容存檔於2017-02-27).
- ^ Khim N, Siv S, Kim S, Mueller T, Fleischmann E, Singh B, Divis PC, Steenkeste N, Duval L, et al. Plasmodium knowlesi infection in humans, Cambodia, 2007-2010. Emerg Infect Dis. 2011, 17 (10): 1900–1902. PMC 3310675 . PMID 22000366. doi:10.3201/eid1710.110355.
- ^ Jeslyn WP, Huat TC, Vernon L, Irene LM, Sung LK, Jarrod LP, Singh B, Ching NL. Molecular Epidemiological Investigation of Plasmodium knowlesi in Humans and Macaques in Singapore. Vector Borne Zoonotic Dis. 2010, 11 (2): 131–5. PMC 3033207 . PMID 20586605. doi:10.1089/vbz.2010.0024.
- ^ Jongwutiwes S, Buppan P, Kosuvin R, Seethamchai S, Pattanawong U, Sirichaisinthop J, Putaporntip C. Plasmodium knowlesi malaria in humans and macaques, Thailand. Emerg Infect Dis. 2011, 17 (10): 1799–1806. PMC 3310673 . PMID 22000348. doi:10.3201/eid1710.110349.
- ^ Yap FL, Cadigan FC, Coatney GR. A presumptive case of naturally occurring Plasmodium knowlesi malaria in man in Malaysia. Trans R Soc Trop Med Hyg. 1971, 65 (6): 839–40. PMID 5003320. doi:10.1016/0035-9203(71)90103-9.
- ^ Barber BE, William T, Jikal M, Jilip J, Dhararaj P, Menon J, Yeo TW, Anstey NM. Plasmodium knowlesi malaria in children. Emerg Infect Dis. 2011, 17 (5): 814–820. PMC 3321776 . PMID 21529389. doi:10.3201/eid1705.101489.
- ^ Wharton RH, Eyles DE. Anopheles hackeri, a vector of Plasmodium knowlesi in Malaya. Science. 1961, 134 (3474): 279–80. PMID 13784726. doi:10.1126/science.134.3474.279.
- ^ Reid JA, Weitz B. Anopheline mosquitoes as vectors of animal malaria in Malaya. Ann Trop Med Parasitol. 1961, 55: 180–6. PMID 13740488.
- ^ Vythilingam I, Tan CH, Asmad M, Chan ST, Lee KS, Singh B. Natural transmission of Plasmodium knowlesi to humans by Anopheles latens in Sarawak, Malaysia. Trans R Soc Trop Med Hyg. 2006, 100 (11): 1087–88. PMID 16725166. doi:10.1016/j.trstmh.2006.02.006.
- ^ Jiram AI, Vythilingam I, Noorazian YM, Yusof YM, Azahari AH, Fong MY. Entomologic investigation of Plasmodium knowlesi vectors in Kuala lipis, Pahang, Malaysia. Malar J. 2012, 11 (1): 213. PMC 3476358 . PMID 22727041. doi:10.1186/1475-2875-11-213.
- ^ 31.0 31.1 31.2 Bronner U.; Divis P.C.; Farnert A.; Singh B. Swedish traveller with Plasmodium knowlesi malaria after visiting Malaysian Borneo. Malar J. 2009, 8: 15. PMC 2634766 . PMID 19146706. doi:10.1186/1475-2875-8-15..
- ^ Krotoski W.A.; Collins W.E. Failure to detect hypnozoites in hepatic tissue containing exoerythrocytic schizonts of Plasmodium knowlesi. Am. J. Trop. Med. Hyg. 1982, 31 (4): 854–856. PMID 7048949.
- ^ Cogswell F.B. The hypnozoite and relapse in primate malaria. Clin. Microbiol. Rev. 1992, 5 (1): 26–35. PMC 358221 . PMID 1735093. doi:10.1128/CMR.5.1.26.
- ^ 存档副本. [2018-11-19]. (原始內容存檔於2017-06-10).
- ^ Daneshvar C, Davis TM, Cox-Singh J, Rafa'ee MZ, Zakaria SK, Divis PC, Singh B. Clinical and parasitological response to oral chloroquine and primaquine in uncomplicated human Plasmodium knowlesi infections. Malar. J. 2010, 9: 238. PMC 2933701 . PMID 20723228. doi:10.1186/1475-2875-9-238.
- ^ Cox-Singh J, Hiu J, Lucas SB, Divis PC, Zulkarnaen M, Chandran P, Wong KT, Adem P, Zaki SR. Severe malaria - a case of fatal Plasmodium knowlesi infection with post-mortem findings: a case report. Malar J. 2010, 9 (1): 10. PMC 2818646 . PMID 20064229. doi:10.1186/1475-2875-9-10.
- ^ Garnham, PCC (1963) A new sub-species of Plasmodium knowlesi in the long-tailed macaque. J Trop Med & Hyg 66 : 156-158
擴展閱讀
編輯- Collins, W. E. Plasmodium knowlesi: A Malaria Parasite of Monkeys and Humans*. Annual Review of Entomology (Submitted manuscript). 2012, 57: 107–121 [2018-11-19]. PMID 22149265. doi:10.1146/annurev-ento-121510-133540. (原始內容存檔於2020-09-23).
警告:默認排序鍵「Plasmodium Knowlesi」覆蓋了之前的默認排序鍵「Plasmodium knowlesi」。