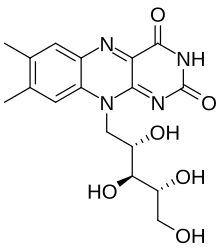
核黃素
核黃素又稱維生素B2、維生素G,分子式C
17H
20N
4O
6,屬於水溶性維生素及維生素B族。[2][4][5]它是合成兩種輔酶——黃素單核苷酸(FMN)及黃素腺嘌呤二核苷酸(FAD)的必要成分。能量代謝、呼吸作用、抗體製造、生長發育都需要這兩種輔酶。此外,它們還涉及到菸鹼酸、維生素B6、葉酸的代謝中。核黃素是治療角膜變薄的處方藥,其口服藥也可減少偏頭痛發生的次數。
 | |
 | |
| 臨床資料 | |
|---|---|
| 其他名稱 | 維生素B2 維生素G[1] |
| AHFS/Drugs.com | Monograph |
| 核准狀況 | |
| 給藥途徑 | 口服、肌內注射、靜脈注射 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學資料 | |
| 生物半衰期 | 66–84分鐘 |
| 排泄途徑 | 尿液 |
| 識別資訊 | |
| |
| CAS號 | 83-88-5 |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| E編碼 | E101、E101(iii) (colours) |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.001.370 |
| 化學資訊 | |
| 化學式 | C17H20N4O6 |
| 莫耳質量 | 376.37 g·mol−1 |
| 3D模型(JSmol) | |
| 熔點 | 278—282 °C(532—540 °F) 分解[3] |
| 水溶性 | 0.07[3] mg/mL (20 °C) |
| |
| |
核黃素缺乏症罕見,通常與其它維生素的缺乏症同時出現,可通過口服膳食補充劑或注射核黃素治療。作為水溶性維生素,過量的核黃素會迅速從尿液排出,使尿液呈亮黃色。核黃素的來源包括肉類、魚類、家禽、蛋類、乳製品、綠色蔬菜、蘑菇、杏仁。有些國家會要求往糧食中添加核黃素。[2]
核黃素是橙黃色粉末,具有微弱氣味及苦味。它難溶於水、乙醇,微溶於環己醇、乙酸戊酯、苄醇,不溶於乙醚、氯仿、丙酮、苯,易溶於稀鹼。[6]核黃素加熱分解會產生含一氧化氮的有毒煙霧。[6]它除了是維生素外也用作食物色素。細菌、真菌、植物都能合成核黃素,但動物不能。核黃素的工業生產最初使用化學合成,目前則通過真菌與細菌發酵來生產核黃素。
功能
編輯核黃素可以合成FMN和FAD這兩種重要的輔酶,[2][7]能量代謝、呼吸作用、抗體製造、生長發育都需要這兩種輔酶。[7]此外,碳水化合物、蛋白質、脂肪的代謝都需要核黃素。[2]把色胺酸轉化成菸鹼酸(維生素B3)需要FAD,[8]而把維生素B6轉化成輔酶磷酸吡哆醛則需要FMN的參與。[8]核黃素還控制了血液中高半胱胺酸的濃度,缺乏核黃素會導致高半胱胺酸濃度上升,增加患上心血管疾病的風險。[8]
氧化還原反應
編輯人體內有約七八十種黃素蛋白(加上其它物種,包括古菌、細菌、真菌的可達上百種),它們要完成單電子及雙電子氧化還原反應需要FMN和FAD。[2][5]在內源性抗氧化劑麩胱甘肽的合成中至關重要的麩胱甘肽還原酶要發揮功能,也需要FAD。[8]
營養代謝
編輯核黃素、FMN、FAD都參與到了菸鹼酸、維生素B6、葉酸的代謝。[4]從色胺酸開始合成輔酶NAD及NADP需要犬尿胺酸3-單加氧酶,後者則需要FAD。核黃素缺乏症會降低NAD及NADP的產量,導致菸鹼酸缺乏症。[4]把維生素B6轉化成輔酶磷酸吡哆醛涉及需要FMN的磷酸吡哆醇氧化酶。[4]涉及葉酸代謝的亞甲基四氫葉酸還原酶需要FAD,才能把高半胱胺酸轉化成胺基酸甲硫胺酸。[4]
缺乏核黃素會影響鐵的代謝,而合成血紅素及紅血球則需要鐵。為同時缺乏核黃素及鐵的人補充核黃素,可以提升鐵補充劑治療缺鐵性貧血的效果。[9]
合成
編輯生物合成
編輯細菌、真菌、植物都能夠合成核黃素,但動物不能。[5]生物合成核黃素的前體是核酮醣-5-磷酸及三磷酸鳥苷。前者被轉化成L-3,4-二羥基-2-丁酮,後者則經一系列反應,最終產生5-胺基-6-(D-核糖醇基胺基)尿嘧啶。這兩種化合物之後在二氧四氫蝶啶合酶催化下縮合,生成6,7-二甲基-8-核糖醇基二氧四氫蝶啶:[10][11][12]
最後,兩分子6,7-二甲基-8-核糖醇基二氧四氫蝶啶在核黃素合酶作用下反應,產生一分子核黃素及5-胺基-6-(D-核糖醇基胺基)尿嘧啶,後者可重新參與合成核黃素的反應。[10][11]
核黃素之後可由核黃素激酶轉化為輔因子FMN,FMN又能被FAD合成酶轉化成FAD。[11][13]
工業生產
編輯工業生產核黃素使用了Ashbya gossypii、Candida famata、棒狀桿菌屬、枯草桿菌等多種微生物。經基因修飾的枯草桿菌的核黃素產量增加,還能抵禦抗生素氨苄西林。這種修飾後的細菌被用於大規模生產用於飼料與營養強化的核黃素。[15]截至2012年,每年都有超過4000噸的核黃素以此方法生產。[16]
在有高濃度碳氫化合物或芳香化合物的環境下,有些細菌可能出於自保,會生產大量的核黃素,如藤黃微球菌。它在吡啶生長時會因為產生核黃素而變黃,但生長在其它基質(如丁二酸)時則不會這樣。[14]
實驗室合成
編輯用途
編輯治療角膜變薄
編輯圓錐角膜患者的角膜會越來越薄。這可通過能增強角膜的角膜交聯術治療。角膜交聯術中會先對角膜使用外用的核黃素溶液,然後將其暴露於UV-A下。[18][19]
預防偏頭痛
編輯2012年,美國神經內科醫學院稱大劑量(400毫克)的核黃素核黃素可能有效預防偏頭痛。[20]2017年的綜述報道每天攝取400毫克的核黃素,持續至少三個月,可以減少成年人發生偏頭痛的次數。[21]不過,目前對使用大劑量核黃素預防或治療兒童和青少年偏頭痛的研究尚無定論,因此不建議他們服用膳食補充劑。[22][2][23]
食用色素
編輯推薦攝入量
編輯美國國家醫學院於1998年更新了核黃素的估計平均需求(EAR)及推薦膳食攝入量(RDA)。14歲或以上的女人和男人對核黃素的EAR分別為每天0.9毫克和1.1毫克,而核黃素的RDA則分別為每天1.0–1.1毫克及1.3毫克。考慮到核黃素需求比平均需求高的人,RDA會比EAR高。孕婦的RDA是每天1.4毫克,哺乳期婦女的則是每天1.6毫克。年齡12個月以下的嬰兒的核黃素RDA未定,他們的適當攝入量(AI)是每天0.3–0.4毫克。1–13歲的兒童的核黃素RDA隨著年齡增長,會從每天0.5毫克增加至每天0.9毫克。美國國家醫學院為了安全,會在證據充足時為各種營養素設可耐受最高攝入量(UL),但因為目前沒有證據表明大劑量核黃素會對人體產生不良影響,所以核黃素沒有UL。EAR、RDA、AI、UL統稱為參考膳食攝入量。[4][25]
| 年齡 | 0–6個月 | 7–12個月 | 1–3歲 | 4–8歲 | 9–13歲 | 14–18歲(女) | 14–18歲(男) | 19歲或以上(女) | 19歲或以上(男) | 孕婦 | 哺乳期婦女 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 估計平均需求 (毫克/天) |
0.3* | 0.4* | 0.4 | 0.5 | 0.8 | 0.9 | 1.1 | 0.9 | 1.1 | 1.2 | 1.3 |
| 推薦膳食攝入量 (毫克/天) |
0.5 | 0.6 | 0.9 | 1.0 | 1.3 | 1.1 | 1.3 | 1.4 | 1.6 |
- *未定,這裡給出的是適當攝入量[4]
歐洲食品安全局則使用膳食參考值,其中用人口參考攝入量(PRI)代替RDA,平均需求(AR)取代EAR,至於AI與UL則與美國國家醫學院一樣。15歲或以上的人的核黃素PRI是每天1.6毫克,孕婦是每天1.9毫克,哺乳期婦女則是每天2.0毫克。1–14歲的兒童的核黃素PRI隨著年齡增長,會從每天0.6毫克增加至每天1.4毫克。這些值比美國國家醫學院設的RDA都高。[26][27]歐洲食品安全局也想過確定核黃素的最高安全攝入量,但因證據不足而無法確定。[28]
| 年齡 | 7–11個月 | 1–3歲 | 4–6歲 | 7–10歲 | 11–14歲 | 15–17歲 | 18歲或以上 | 孕婦 | 哺乳期婦女 |
|---|---|---|---|---|---|---|---|---|---|
| 平均需求 (毫克/天) |
0.4* | 0.5 | 0.6 | 0.8 | 1.1 | 1.4 | 1.3 | 1.5 | 1.7 |
| 人口參考攝入量 (毫克/天) |
0.6 | 0.7 | 1.0 | 1.4 | 1.6 | 1.6 | 1.9 | 2.0 |
- *未定,這裡給出的是適當攝入量[27]
來源
編輯
|
|
|
小麥磨成麵粉後,核黃素含量會只剩下原來的67%,[30]因此部分國家會要求往麵粉添加核黃素。[31]此外,核黃素也被添加到穀物片中。[32]由於核黃素難溶於水(溶解度0.07 mg/mL[3]),核黃素難以添加到液態食物中,因此在這裡會用更易溶於水的FMN(溶解度92 mg/mL[33])代替核黃素。[24]這些食物中添加的核黃素大大增加了其攝入量。動物性的核黃素來源通常含有游離的核黃素,以及與蛋白質結合的FMN、FAD。牛奶主要含有游離的核黃素,但也含有少量FMN及FAD。[34]
營養強化
編輯部分國家要求或推薦往糧食中添加核黃素。[31]截至2024年,共有57個國家(大多為美洲及東非國家)要求往麵粉添加核黃素或其衍生物黃素單核苷酸鈉,添加量在1.3–5.75 mg/kg之間。[35]此外,另有16個國家推薦核黃素的營養強化。[35]舉個例子,印度政府推薦往麥達麵粉和阿塔麵粉中添加4.0 mg/kg的核黃素。[36]
吸收、代謝、排泄
編輯食物中超過90%的核黃素都以與蛋白質結合的FMN或FAD的形式存在。[2]它們與胃酸反應,釋放FMN、FAD,然後被小腸中的酶水解成核黃素。[37]
核黃素經快速的主動運輸過程吸收,高濃度下會有一部分經被動運輸過程吸收。[37]膽酸能夠促進核黃素的吸收,因此飯時服用核黃素可促進其吸收。[4][5]大部分核黃素會先去到肝臟。[5]目前已發現三種核黃素運輸蛋白,分別是存在於小腸、胎盤的RFVT1,存在於腦、唾液腺的RFVT2,以及存在於小腸、睪丸、前列腺的RFVT3。[5][38]編碼這些運輸蛋白的基因發生突變的嬰兒可通過口服核黃素治療。[38]
核黃素、FMN、FAD可以相互轉化。核黃素激酶可把核黃素轉化成FMN,而磷酸酶則可把FMN變回核黃素。FMN至FAD的轉化需要FAD合成酶,而逆反應則需要焦磷酸酶。FAD本身即是FAD合成酶的抑制劑,會抑制FAD的合成。[5]
體內過量的核黃素會被小腸吸收,然後迅速從尿液排出。[5]尿液的顏色通常可用於測量身體水含量,[39]但大劑量的核黃素會導致尿液比平時更黃,影響結果。[40]正常飲食下,尿液中的核黃素約有三分之二仍以核黃素形式存在,其餘的被細胞代謝成羥甲基核黃素等代謝物。當攝入的核黃素超過小腸可吸收的量時,剩餘的核黃素就能來到大腸,被細菌分解代謝,然後從糞便排出。[5]有猜想認為這些核黃素會影響大腸菌群。[41]
缺乏症
編輯症狀
編輯核黃素缺乏症會導致嘴唇乾裂、口角炎、喉嚨痛、舌頭髮紅疼痛、脫髮。[2]此外,患者的眼睛會發癢、流淚、充滿血絲、畏光。[2]核黃素缺乏症還與貧血相關。 [42] 長期缺乏核黃素可能導致肝臟和神經系統退化。[2][4]孕婦缺乏核黃素會增加子癇前症的風險,[2][8]還會使胎兒出現先天性障礙,包括畸形的心臟與肢體。[43][44]
風險因素
編輯有患上核黃素缺乏症風險的人包括酗酒者、素食運動員、純素主義者。[2]孕婦或哺乳期婦女如果不攝取肉類及乳製品,那麼她們以及她們的嬰兒也都會有患上核黃素缺乏症的風險。[2][8]厭食症患者不常攝取到足夠的核黃素,而乳糖不耐症患者則會避免攝入富含核黃素的乳製品,也難以獲得足夠的核黃素,因此都暴露於核黃素缺乏症的風險下。[8]運動員和勞動者等體力需求較高的人可能需要攝入更多的核黃素。[8]甲減患者、腎上腺機能不全、缺乏核黃素載體蛋白的人將核黃素轉化成FAD、FMN的過程中會出現問題。[8]
病因
編輯核黃素缺乏症通常與其它營養的缺乏症,尤其是其它水溶性維生素缺乏症同時出現。[2]它可由飲食缺乏核黃素,身體大量排出核黃素,或是因為身體無法吸收、利用核黃素引起。[8]純素食及不食用乳製品都會提高患核黃素缺乏症的風險。[5]此外,癌症、心臟病、糖尿病都會引起或加劇核黃素缺乏症。[4]
有些罕見的基因缺陷會影響核黃素的吸收、運輸、代謝或利用。[38][45]此類基因缺陷的例子是影響核黃素運輸的Brown–Vialetto–Van Laere症候群,患者分別編碼運輸蛋白RDVT2和RDVT3的基因SLC52A2及SLC52A3有缺陷。[38][45]嬰幼兒患者的症狀包括肌肉無力(之後會導致呼吸功能受損)、失明、失聰、共濟失調。[45]如果未經治療,他們將必須靠呼吸機生存,且大多會在12歲前去世。他們可通過終身口服大劑量核黃素治療。[38][45]
診斷與評估
編輯評估核黃素狀態對於確認懷疑患核黃素缺乏症的病例至關重要。健康的成年人一天會排泄約120微克的核黃素,而核黃素缺乏症患者一天排泄的核黃素少於40微克。[2][46]核黃素排泄量會隨年齡增長而減少,受到慢性壓力及服用某些處方藥則會增加核黃素的排泄量。[2]
人體內核黃素狀態可用紅血球麩胱甘肽還原酶、紅血球黃素濃度、尿液中核黃素排泄量評估。[4][5]紅血球麩胱甘肽還原酶活度係數(EGRAC)可用於測量長期的核黃素狀態。[46][2]培養兩組紅血球麩胱甘肽還原酶,其中一組的培養基加有FAD,另一組沒有,它們活性的比例即是EGRAC。EGRAC在1.0–1.2之間說明人體核黃素含量充足,1.2–1.4說明人體核黃素含量較少,超過1.4時則代表患有核黃素缺乏症。[2][5]紅血球黃素濃度超過400 nmol/L說明人體核黃素含量充足,核黃素缺乏症的這個值則低於270 nmol/L。[4][46]尿液排泄量使用核黃素與肌酐的比例表示。這個比例在50–72 nmol/g之間說明核黃素含量較低,50 nmol/g以下則代表缺乏核黃素。尿液中核黃素排泄量也可用於確認核黃素攝入量。對成年男人來說,當口服核黃素從0.5毫克增加至1.1毫克時,一天排出的尿液中核黃素的含量會緩慢呈線性增加,達到100微克。[4]核黃素攝入量超過1.1毫克時,尿液中核黃素排泄量就會迅速增加。在攝入量2.5毫克時,一天的尿液中核黃素排泄量高達800微克。[4]
攝入過量
編輯目前沒有證據表明過量攝入核黃素有毒。人攝入核黃素越多,吸收率就會越少,多餘的核黃素都會隨尿液排出體外,使尿液變成亮黃色。[5][25][40]在研究用核黃素治療偏頭痛的臨床研究中,受試者連續3–12個月都口服400毫克的核黃素,產生的副作用有腹痛及腹瀉。[21]
歷史
編輯核黃素最早的發現比維生素的概念要早。Alexander Wynter Blyth在1880年前後從牛奶乳清中分離出了一種黃色、可溶於水的物質,它在光照下會放出黃綠色螢光。這種物質便是今天的核黃素。不過,Blyth無法研究這種物質的化學組成和性質。[1][16]
1900年代初,多所研究機構正在研究對維持大鼠生長至關重要的食物成分。這些成分最初被分成脂溶性的維生素A與水溶性的維生素B。維生素B後來又被分成對熱不穩定的維生素B1及對熱穩定的維生素B2。[1]維生素B2原本被認為是預防糙皮病所需的營養素,但後來發現菸鹼酸(維生素B3)才是真正預防糙皮病的營養素。產生該誤解的原因是維生素B2缺乏症的症狀口腔炎與糙皮病的症狀類似,只是沒有出現大面積的周圍皮膚病變。[47]
1935年,保羅·捷爾吉、里夏德·庫恩、T. Wagner-Jauregg發現大鼠如果不攝取維生素B2,體重就不會增加。[48]從酵母中可分離出一種會放出黃綠色螢光的物質(即核黃素),它可以使大鼠恢復正常生長,恢復程度與螢光強度成正比。1933年,研究人員通過這一性質,從蛋清中分離出這種物質。隨後,同一研究小組團隊又從乳清中分離出一種類似的物質。1934年,庫恩的研究團隊發現這兩種物質是同一種物質,將其命名為核黃素,並成功合成了它。[1]
核黃素在約1937年時也被稱為維生素G。[49]1938年,庫恩因他對維生素的研究,榮獲諾貝爾化學獎。[50]1939年,William H. Sebrell和Roy E. Butler通過臨床試驗證明了核黃素是必需營養素。他們發現婦女食用低核黃素飲食會患上口腔炎及其它症狀,這些症狀在用核黃素補充劑治療後緩解,但在停止服用核黃素補充劑後又會復發。[1]
參考
編輯- ^ 1.0 1.1 1.2 1.3 1.4 Northrop-Clewes CA, Thurnham DI. The discovery and characterization of riboflavin. Annals of Nutrition & Metabolism. 2012, 61 (3): 224–30. PMID 23183293. S2CID 7331172. doi:10.1159/000343111.
- ^ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 2.13 2.14 2.15 2.16 2.17 2.18 Riboflavin: Fact Sheet for Health Professionals. Office of Dietary Supplements, US National Institutes of Health. 2022-05-11 [2023-08-20]. (原始內容存檔於2020-02-24).
- ^ 3.0 3.1 3.2 Record of Riboflavin in the GESTIS Substance Database from the IFA
- ^ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 4.14 Institute of Medicine. Riboflavin. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, DC: The National Academies Press. 1998: 87–122 [2017-08-29]. ISBN 978-0-309-06554-2. (原始內容存檔於2015-07-17).
- ^ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 Merrill AH, McCormick DB. Riboflavin. BP Marriott, DF Birt, VA Stallings, AA Yates (編). Present Knowledge in Nutrition, Eleventh Edition. London, United Kingdom: Academic Press (Elsevier). 2020: 189–208. ISBN 978-0-323-66162-1.
- ^ 6.0 6.1 6.2 Riboflavin. PubChem, US National Library of Medicine. 2021-10-09 [2021-10-15]. (原始內容存檔於2021-03-21).
- ^ 7.0 7.1 Mewies M, McIntire WS, Scrutton NS. Covalent attachment of flavin adenine dinucleotide (FAD) and flavin mononucleotide (FMN) to enzymes: The current state of affairs. Protein Science. 1998, 7 (1): 7–20. PMC 2143808 . PMID 9514256. doi:10.1002/pro.5560070102 .
- ^ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 Riboflavin. Micronutrient Information Center, Linus Pauling Institute, Oregon State University. 2013 [2021-10-08]. (原始內容存檔於2010-02-11).
- ^ Fishman SM, Christian P, West KP. The role of vitamins in the prevention and control of anaemia. Public Health Nutr. June 2000, 3 (2): 125–50. PMID 10948381. doi:10.1017/s1368980000000173 .
- ^ 10.0 10.1 Fischer M, Bacher A. Biosynthesis of vitamin B2: Structure and mechanism of riboflavin synthase. Archives of Biochemistry and Biophysics. 2008, 474 (2): 252–265. PMID 18298940. doi:10.1016/j.abb.2008.02.008.
- ^ 11.0 11.1 11.2 Caspi R. Pathway: flavin biosynthesis III (fungi). MetaCyc Metabolic Pathway Database. 2009-03-17 [2021-11-21]. (原始內容存檔於2021-11-21).
- ^ Wei Y, Kumar P, Wahome N, Mantis NJ, Middaugh CR. Biomedical Applications of Lumazine Synthase. Journal of Pharmaceutical Sciences. 2018, 107 (9): 2283–96 [2021-12-29]. PMID 29763607. S2CID 21729139. doi:10.1016/j.xphs.2018.05.002. (原始內容存檔於2024-03-20).
- ^ Devlin TM. Textbook of Biochemistry: with Clinical Correlations 7th. Hoboken, NJ: John Wiley & Sons. 2011. ISBN 978-0-470-28173-4.
- ^ 14.0 14.1 Sims GK, O'loughlin EJ. Riboflavin Production during Growth of Micrococcus luteus on Pyridine. Applied and Environmental Microbiology. October 1992, 58 (10): 3423–5. Bibcode:1992ApEnM..58.3423S. PMC 183117 . PMID 16348793. doi:10.1128/AEM.58.10.3423-3425.1992.
- ^ Stahmann KP, Revuelta JL, Seulberger H. Three biotechnical processes using Ashbya gossypii, Candida famata, or Bacillus subtilis compete with chemical riboflavin production. Applied Microbiology and Biotechnology. May 2000, 53 (5): 509–16. PMID 10855708. S2CID 2471994. doi:10.1007/s002530051649.
- ^ 16.0 16.1 16.2 Eggersdorfer M, Laudert D, Létinois U, McClymont T, Medlock J, Netscher T, Bonrath W. One hundred years of vitamins-a success story of the natural sciences. Angewandte Chemie. December 2012, 51 (52): 12960–12990. PMID 23208776. doi:10.1002/anie.201205886.
- ^ Kuhn R, Reinemund K, Weygand F, Ströbele R. Über die Synthese des Lactoflavins (Vitamin B 2 ). Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 1935, 68 (9): 1765–1774. doi:10.1002/cber.19350680922 (德語).
- ^ Mastropasqua L. Collagen cross-linking: when and how? A review of the state of the art of the technique and new perspectives. Eye and Vision. 2015, 2: 19. PMC 4675057 . PMID 26665102. doi:10.1186/s40662-015-0030-6 .
- ^ Sorkin N, Varssano D. Corneal collagen crosslinking: a systematic review. Ophthalmologica. June 2014, 232 (1): 10–27. PMID 24751584. S2CID 32696531. doi:10.1159/000357979 .
- ^ Holland S, Silberstein SD, Freitag F, Dodick DW, Argoff C, Ashman E. Evidence-based guideline update: NSAIDs and other complementary treatments for episodic migraine prevention in adults: report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society. Neurology. April 2012, 78 (17): 1346–53. PMC 3335449 . PMID 22529203. doi:10.1212/wnl.0b013e3182535d0c.
Riboflavin is probably effective for migraine prevention (1 Class I trial and 1 imprecise Class II study).
- ^ 21.0 21.1 Thompson DF, Saluja HS. Prophylaxis of migraine headaches with riboflavin: A systematic review. Journal of Clinical Pharmacy and Therapeutics. August 2017, 42 (4): 394–403. PMID 28485121. S2CID 29848028. doi:10.1111/jcpt.12548 .
- ^ Riboflavin. Drugs.com. 2021-07-22 [2021-10-08]. (原始內容存檔於2016-12-30).
- ^ Sherwood M, Goldman RD. Effectiveness of riboflavin in pediatric migraine prevention. Canadian Family Physician. March 2014, 60 (3): 244–6. PMC 3952759 . PMID 24627379.
- ^ 24.0 24.1 Approved additives and E numbers. food.gov.uk. UK Food Standards Agency. 2023-08-10 [2023-08-20]. (原始內容存檔於2020-09-26).
- ^ 25.0 25.1 Gropper SS, Smith JL, Groff JL. Ch. 9: Riboflavin. Advanced Nutrition and Human Metabolism 5th. Wadsworth: CENGAG Learning. 2009: 329–33. ISBN 9780495116578.
- ^ Turck D, Bresson JL, Burlingame B, Dean T, Fairweather-Tait S, Heinonen M, Hirsch-Ernst KI, Mangelsdorf I, McArdle HJ, Naska A, Nowicka G, Pentieva K, Sanz Y, Siani A, Sjödin A, Stern M, Tomé D, Van Loveren H, Vinceti M, Willatts P, Lamberg-Allardt C, Przyrembel H, Tetens I, Dumas C, Fabiani L, Forss AC, Ioannidou S, Neuhäuser-Berthold M. Dietary Reference Values for riboflavin. EFSA J. August 2017, 15 (8): e04919. PMC 7010026 . PMID 32625611. doi:10.2903/j.efsa.2017.4919.
- ^ 27.0 27.1 27.2 Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies (PDF): 10–13. 2017. (原始內容存檔 (PDF)於2017-08-28).
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF). European Food Safety Authority. 2006. (原始內容存檔 (PDF)於2016-03-16).
- ^ 29.0 29.1 29.2 29.3 USDA Food Composition Databases; Food Search; SR Legacy Foods. United States Department of Agriculture, Agricultural Research Service. Release 28. [2024-08-01]. (原始內容存檔於2023-05-23).
- ^ Batifoulier, F; Verny, MA; Chanliaud, E; Rémésy, C; Demigné, C. Variability of B vitamin concentrations in wheat grain, milling fractions and bread products. European Journal of Agronomy. 2006, 25 (2): 163–69. doi:10.1016/j.eja.2006.04.009.
- ^ 31.0 31.1 What nutrients are added to flour and rice in fortification?. Food Fortification Initiative. 2021 [2021-10-08]. (原始內容存檔於2021-10-08).
- ^ Sachdev, Poonam. Healthy Foods High in Riboflavin. WebMD. 2022-11-23 [2024-07-31]. (原始內容存檔於2024-07-31).
- ^ Flavin mononucleotide. Human Metabolome Database. [2024-06-08]. (原始內容存檔於2024-08-06).
- ^ Kanno C, Kanehara N, Shirafuji K, Tanji R, Imai T. Binding form of vitamin B2 in bovine milk: its concentration, distribution and binding linkage. Journal of Nutritional Science and Vitaminology. February 1991, 37 (1): 15–27. PMID 1880629. doi:10.3177/jnsv.37.15 .
- ^ 35.0 35.1 Map: Count of Nutrients In Fortification Standards. Global Fortification Data Exchange. [2024-07-31]. (原始內容存檔於2019-04-11).
- ^ Direction under Section 16(5) of Foods Safety and Standards Act, 2006 regarding Operationalisation of Food Safety & Standards (Fortification of Foods) Regulations, 2017 relating to standards for fortification of food (PDF). Food Safety & Standards Authority of India (FSSAI). 2017-05-19 [2021-11-30]. (原始內容存檔 (PDF)於2021-12-17).
- ^ 37.0 37.1 Zempleni J, Galloway JR, McCormick DB. Pharmacokinetics of orally and intravenously administered riboflavin in healthy humans. American Journal of Clinical Nutrition. January 1996, 63 (1): 54–66. PMID 8604671. doi:10.1093/ajcn/63.1.54 .
- ^ 38.0 38.1 38.2 38.3 38.4 Jaeger B, Bosch AM. Clinical presentation and outcome of riboflavin transporter deficiency: mini review after five years of experience. Journal of Inherited Metabolic Disease. July 2016, 39 (4): 559–64. PMC 4920840 . PMID 26973221. doi:10.1007/s10545-016-9924-2.
- ^ Ellis LA, Yates BA, McKenzie AL, Muñoz CX, Casa DJ, Armstrong LE. Effects of Three Oral Nutritional Supplements on Human Hydration Indices. Int J Sport Nutr Exerc Metab. August 2016, 26 (4): 356–62. PMID 26731792. doi:10.1123/ijsnem.2015-0244.
- ^ 40.0 40.1 Riboflavin (Oral Route). Mayo Clinic. February 2021 [2021-10-28]. (原始內容存檔於2021-10-28).
- ^ Steinert RE, Sadaghian Sadabad M, Harmsen HJ, Weber P. The prebiotic concept and human health: a changing landscape with riboflavin as a novel prebiotic candidate?. Eur J Clin Nutr. December 2016, 70 (12): 1348–1353. PMID 27380884. S2CID 29319823. doi:10.1038/ejcn.2016.119 .
- ^ Thakur K, Tomar SK, Singh AK, Mandal S, Arora S. Riboflavin and health: A review of recent human research. Crit Rev Food Sci Nutr. November 2017, 57 (17): 3650–3660. PMID 27029320. S2CID 205692748. doi:10.1080/10408398.2016.1145104.
- ^ Smedts HP, Rakhshandehroo M, Verkleij-Hagoort AC, de Vries JH, Ottenkamp J, Steegers EA, Steegers-Theunissen RP. Maternal intake of fat, riboflavin and nicotinamide and the risk of having offspring with congenital heart defects. European Journal of Nutrition. October 2008, 47 (7): 357–65. PMID 18779918. S2CID 25548935. doi:10.1007/s00394-008-0735-6.
- ^ Robitaille J, Carmichael SL, Shaw GM, Olney RS. Maternal nutrient intake and risks for transverse and longitudinal limb deficiencies: data from the National Birth Defects Prevention Study, 1997-2003. Birth Defects Research. Part A, Clinical and Molecular Teratology. September 2009, 85 (9): 773–9 [2019-12-17]. PMID 19350655. doi:10.1002/bdra.20587. (原始內容存檔於2020-06-13).
- ^ 45.0 45.1 45.2 45.3 Cali E, Dominik N, Manole A, Houlden H. Riboflavin transporter deficiency. GeneReviews (Adam MP, Ardinger HH, Pagon RA, et Al., Editors) (University of Washington, Seattle). 2021-04-08 [2021-11-20]. PMID 26072523. (原始內容存檔於2021-12-06).
- ^ 46.0 46.1 46.2 Hoey L, McNulty H, Strain JJ. Studies of biomarker responses to intervention with riboflavin: a systematic review. The American Journal of Clinical Nutrition. June 2009, 89 (6): 1960S–1980S. PMID 19403631. doi:10.3945/ajcn.2009.27230b.
- ^ Sebrell WH, Butler RE. Riboflavin Deficiency in Man (Ariboflavinosis). Public Health Reports. 1939, 54 (48): 2121–31. JSTOR 4583104. doi:10.2307/4583104.
- ^ György P. Investigations on the vitamin B(2) complex: The differentiation of lactoflavin and the "rat antipellagra" factor. The Biochemical Journal. March 1935, 29 (3): 741–759. PMC 1266542 . PMID 16745720. doi:10.1042/bj0290741.
- ^ Levine H, Remington RE. The Vitamin G Content of Some Foods. J Nutr. May 1937, 13 (5): 525–42 [2021-10-05]. doi:10.1093/jn/13.5.525. (原始內容存檔於2024-03-20).
- ^ The Nobel Prize in Chemistry 1938. Nobelprize.org. [2018-07-05]. (原始內容存檔於2018-07-08).