紫杉醇合成
紫杉醇全合成指有机化学中各种以紫杉醇为目标分子的全合成路线。作为一种重要的紫杉烷类化合物,长期以来紫杉醇合成都是有机合成研究中炙手可热的领域之一。[注 1] 紫杉醇是一种发现于太平洋紫杉(Taxus brevifolia)中具抗癌活性的双萜,由于提取来源的稀少和不可持续性,因此价格十分昂贵。不少研究者希望借研究紫杉醇合成来使其生产成本得到降低,同时研究其衍生物的性质促进对其机制的理解,以及发现潜在的更佳的抗癌药物。
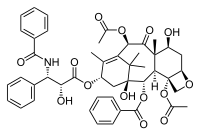
紫杉醇分子含一个四环核心(巴卡丁Ⅲ)及一个酰胺尾。四个环系从左至右分别称为A环(环己烯)、B环(环辛烷)、C环(环己烷)和D环(噁丁环)。
紫杉醇的药物开发历时逾40年,1955年,美国政府下属的国家癌症研究中心实施一项植物筛选计划,寻找具抗癌活性的化合物。[1]1964年,太平洋紫杉树皮(T. brevifolia Nutt.)的提取物被发现具有抗肿瘤活性。[1]。1966年发现和确定了其中的活性成分紫杉醇,后将其命名为Taxol。[1]1971年完成了紫杉醇的结构测定。从1982年起,佛罗里达州立大学的罗伯特·霍尔顿开始对紫杉醇全合成进行研究。1989年他发展了一条从10-脱乙酰基巴卡丁Ⅲ到紫杉醇的半合成路线,1994年他又完成了紫杉醇的首次全合成。前体10-脱乙酰基巴卡丁Ⅲ以(比紫杉醇)更高量存在于欧洲紫杉中。1990年时,这条半合成路线的专利被施贵宝公司购买并用于生产紫杉醇,在1999年紫杉醇作为百时美施贵宝公司在全球销售的品牌药品给佛罗里达州立大学与霍尔顿(拿取40%分成)赚到150亿美元的销售额[2],可见紫杉醇的惊人经济价值。
全合成
编辑紫杉醇全合成是20世纪90年代最热门的合成领域之一[3] 至1992年曾吸引约30个研究团队投入进来。不过至今完成其全合成的仅有七组,最先完成的是霍尔顿团队和尼古拉团队,两者几乎同时完成。霍尔顿等先将结果寄到期刊,不过是尼古拉等的文献先在期刊发表。
对紫杉醇的合成路线有些是严格意义上的全合成,有些则是以一天然存在的分子作为合成前体。不过各种合成策略的共性是先合成巴卡丁环系,最后利用基于尾岛内酰胺的方法(一种路线除外)加上侧链。相关资料列在下面。注意这里的字母表示上面提到的环系编号。
- 霍尔顿紫杉醇全合成 - 1994年 - 前体:广藿香醇 - 策略:线性合成 AB → C → D
- 尼古劳紫杉醇全合成 - 1994年 - 前体:黏酸 - 策略:收敛合成 A + C → ABC → D
- 丹尼谢夫斯基紫杉醇全合成 - 1996年 - 前体:维兰德-米舍尔酮 - 策略:收敛合成 C + D → + A → ABCD
- 温德尔紫杉醇全合成 - 1997年 - 前体:蒎烯 - 策略:线性合成 AB → C → D[4][5]
- 向山光昭紫杉醇全合成 - 1998年 - 前体:合成构素 - 策略:线性合成 A → B → C → D[6][7]
- 桑嶋功紫杉醇全合成 - 1998年 - 前体:L-丝氨酸 - 策略:线性合成 B → C → A → D[8]
- 高桥孝志紫杉醇合成(外消旋表全合成) - 2006年 - 前体:牻牛儿醇 - 策略:收敛合成 A + C → ABC → D[9]
半合成
编辑百时美施贵宝公司用的半合成路线是以10-脱乙酰基巴卡丁Ⅲ为前体,利用尾岛内酰胺与其羟基的缩合,引入侧链。
澳洲天然药业公司的半合成法是以初级代谢产物紫杉烷为前体。紫杉烷与紫杉醇不同之处在于侧链,紫杉烷侧链的R基(下图)可以是苯基、丙基或戊基等,但紫杉醇的侧链R基只能是苯基。用施瓦茨试剂将紫杉烷中的酰胺部分转化为胺(经亚胺,最后酸化),再经苯甲酰化,就得紫杉醇。
提取原料紫杉来源于美国密歇根州,8年长成,定期断枝。干燥后的原料被运至墨西哥,进行第一步提取(至10%紫杉醇)。再送到加拿大,提取至95%纯。最后在中国进行半合成。[2]
生物合成
编辑紫杉醇的生物合成约含20步酶促反应,完整的合成途径仍不是很清楚,不过已知的部分与已用的人工方法大相径庭。起始物双牻牛基焦磷酸(2)[10]是牻牛儿醇(1)的二聚形式,已含有紫杉醇骨架中全部20个碳原子。(2)经关环得(3),再经衍生化得紫杉新素(4),最后修饰得到10-脱乙酰基巴卡丁Ⅲ(5)。生物合成对反应的立体化学特征有很强的控制,且可以借助细胞色素P450很容易在碳骨架上引入氧连取代基,这些在目前实验室中还都是无法实现的。
外部链接
编辑- Holton founded http://www.taxolog.com (页面存档备份,存于互联网档案馆) for Taxol research
- Miamiherald in 2005 reported on a funding dispute for a new FSU chemistry building Article
- ...an issue that continues into 2006: Chemistry Building Battle Update Elizabeth K. Wilson Chemical & Engineering News September 6, 2006 Link (页面存档备份,存于互联网档案馆)
- The complete Taxol story from Chemical & Engineering News: Article (页面存档备份,存于互联网档案馆)
- Caltech taxol overview[永久失效連結]
- extensive Florida State University article
- story of taxol total synthesis
参考资料
编辑- ^ 1.0 1.1 1.2 Yu-Fang Wang, Qing-Wen Shi, Mei Dong, Hiromasa Kiyota, Yu-Cheng Gu, and Bin Cong. Natural Taxanes: Developments Since 1828. Chem. Rev. 2011, 111 (12): 7652–7709 [2012-09-05]. doi:10.1021/cr100147u. (原始内容存档于2019-12-08).
- ^ 2.0 2.1 Bruce Ganem and Roland R. Franke. Paclitaxel from Primary Taxanes: A Perspective on Creative Invention in Organozirconium Chemistry. J. Org. Chem. 2007, 72 (11): 3981–3987 [2012-09-05]. doi:10.1021/jo070129s. (原始内容存档于2019-12-14).
- ^ Nina Hall. Creating complexity – the beauty and logic of synthesis. Chem. Commun. 2003: 661 – 664. doi:10.1039/b212248k.
- ^ Paul A. Wender, Neil F. Badham, Simon P. Conway, Paul E. Floreancig, Timothy E. Glass, Christian Gränicher, Jonathan B. Houze, Jan Jänichen, Daesung Lee, Daniel G. Marquess, Paul L. McGrane, Wei Meng, Thomas P. Mucciaro, Michel Mühlebach, Michael G. Natchus, Holger Paulsen, David B. Rawlins, Jeffrey Satkofsky, Anthony J. Shuker, James C. Sutton, Richard E. Taylor, and Katsuhiko Tomooka. The Pinene Path to Taxanes. 5. Stereocontrolled Synthesis of a Versatile Taxane Precursor. J. Am. Chem. Soc. 1997, 119 (11): 2755 –2756. doi:10.1021/ja9635387.
- ^ Paul A. Wender, Neil F. Badham, Simon P. Conway, Paul E. Floreancig, Timothy E. Glass, Jonathan B. Houze, Nancy E. Krauss, Daesung Lee, Daniel G. Marquess, Paul L. McGrane, Wei Meng, Michael G. Natchus, Anthony J. Shuker, James C. Sutton, and Richard E. Taylor. The Pinene Path to Taxanes. 6. A Concise Stereocontrolled Synthesis of Taxol. J. Am. Chem. Soc. 1997, 119 (11): 2757–2758. doi:10.1021/ja963539z.
- ^ Koichiro Morihira, Ryoma Hara, Shigeru Kawahara, Toshiyuki Nishimori, Nobuhito Nakamura, Hiroyuki Kusama, and Isao Kuwajima. Enantioselective Total Synthesis of Taxol. J. Am. Chem. Soc. 1998, 120 (49): 12980–12981.
- ^ Hiroyuki Kusama, Ryoma Hara, Shigeru Kawahara, Toshiyuki Nishimori, Hajime Kashima, Nobuhito Nakamura, Koichiro Morihira, and Isao Kuwajima. Enantioselective Total Synthesis of (-)-Taxol. J. Am. Chem. Soc. 2000, 122 (16): 3811–3820 [2012-09-05]. doi:10.1021/ja9939439. (原始内容存档于2019-12-08).
- ^ Isamu Shiina, Hayato Iwadare, Hiroki Sakoh, Masatoshi Hasegawa, Yu-ichirou Tani, and Teruaki Mukaiyama. A New Method for the Synthesis of Baccatin Ⅲ. Chemistry Letters. 1998, 27 (1): 1–2 [2012-09-05]. doi:10.1246/cl.1998.1. (原始内容存档于2019-11-06).
- ^ Takayuki Doi, Shinichiro Fuse, Shigeru Miyamoto, Kazuoki Nakai, Daisuke Sasuga and Takashi Takahashi. A Formal Total Synthesis of Taxol Aided by an Automated Synthesizer. Chemistry an Asian J. 2006, 1 (3): 370–383 [2012-09-05]. doi:10.1002/asia.200600156. (原始内容存档于2017-07-14).
- ^ MyDoanh Chau, Stefan Jennewein, Kevin Walker, and Rodney Croteau. Taxol Biosynthesis: Molecular Cloning and Characterization of a Cytochrome P450 Taxoid 7β-Hydroxylase. Chemistry and Biology: 663–672. [2012-09-05]. doi:10.1016/j.chembiol.2004.02.025. (原始内容存档于2014-03-08).
- ^ Ajikumar, P. K.; Xiao, W.-H.; Tyo, K. E. J.; Wang, Y.; Simeon, F.; Leonard, E.; Mucha, O.; Phon, T. H.; Pfeifer, B.; et al. Isoprenoid Pathway Optimization for Taxol Precursor Overproduction in Escherichia coli. Science. 2010, 330 (6000): 70–4. Bibcode:2010Sci...330...70A. PMC 3034138 . PMID 20929806. doi:10.1126/science.1191652.
注释
编辑- ^ 紫杉醇现通用名为Paclitaxel。1992年前通用名为Taxol,该名称也见于一些早期文献中。