氟化亚铁
化合物
氟化亚铁为铁的一种氟化物,化学式为FeF2。它的无水物和水合物都是白色晶体。[1][8]
| 氟化亚铁 | |
|---|---|
| |
| 别名 | 二氟化铁 氟化铁(II) |
| 识别 | |
| CAS号 | 7789-28-8(无水) 13940-89-1(四水) |
| PubChem | 522690 |
| ChemSpider | 74215 |
| SMILES |
|
| InChI |
|
| InChIKey | FZGIHSNZYGFUGM-NUQVWONBAX |
| 性质 | |
| 化学式 | F2Fe |
| 摩尔质量 | 93.84 g·mol−1 |
| 外观 | 无色透明晶体[1] 四水合物为棕色固体[2] |
| 密度 | 4.09 g/cm3(无水)[3][4] 2.20 g/cm3(四水合物)[2] |
| 熔点 | 970 °C(无水) 100 °C(四水合物)[5] |
| 沸点 | 1100 °C(无水) |
| 溶解性(水) | 微溶[3] |
| 溶度积Ksp | 2.36×10−6[6] |
| 溶解性 | 不溶於乙醇、乙醚和苯[4] 可溶於氫氟酸 |
| 磁化率 | +9500.0·10−6 cm3/mol |
| 结构 | |
| 晶体结构 | 金红石(四方晶系),tP6 |
| 空间群 | P42/mnm, No. 136 |
| 危险性 | |
GHS危险性符号  
| |
| 主要危害 | 造成严重的皮肤灼伤和眼睛损伤 燃烧形成危险的分解产物[7] |
| NFPA 704 | |
| 闪点 | 不适用[7] |
| 相关物质 | |
| 其他阴离子 | 氧化亚铁 氯化亚铁 溴化亚铁 碘化亚铁 |
| 其他阳离子 | 二氟化锰 氟化鈷(II) |
| 相关化学品 | 三氟化铁 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
结构和成键
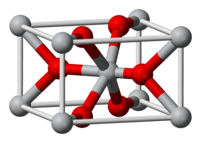
编辑无水FeF2是金红石结构的。其中的铁离子是八面体形结构,而氟离子则是平面三角形结构的。[9][10]
物理性质
编辑FeF2在958至1178 K下昇華。通过扭转法和Knudsen的方法,氟化亚铁的昇华热被实验确定为 271 ± 2 kJ mole−1。[12]
氟化亚铁的以下反应用于计算Fe+的原子化能:[13]
- FeF2 + e → Fe+ + F2(或2F) + 2e
制备和反应
编辑无水氟化亚铁可以由氯化亚铁和无水氟化氢反应而成。[14]它微溶于水(25 °C下的溶度积 Ksp = 2.36×10−6)[15]和稀氢氟酸,产生浅绿色溶液。[1]它不溶于有机溶剂。[8]
氟化亚铁的四水合物则可以通过铁和温热氢氟酸反应,并通过添加乙醇产生沉淀而成。[1]它在潮湿空气中氧化产生三氟化铁水合物 (FeF3)2·9H2O。[1]
用处
编辑外部链接
编辑参考文献
编辑- ^ 1.0 1.1 1.2 1.3 1.4 1.5 Penfold, B. R.; Taylor, M. R. The crystal structure of a disordered form of iron(II) fluoride tetrahydrate. Acta Crystallographica. 1960, 13 (11): 953–956. doi:10.1107/S0365110X60002302.
- ^ 2.0 2.1 David R. Lide., CRC Handbook of Chemistry and Physics. 90., CRC Press. 2009, (德文)
- ^ 3.0 3.1 Record of Eisen(II)-fluorid in the GESTIS Substance Database from the IFA
- ^ 4.0 4.1 Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 274.
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ John Rumble. CRC Handbook of Chemistry and Physics 99. CRC Press. June 18, 2018: 5-188. ISBN 1138561630 (英语).
- ^ 7.0 7.1 Sigma-Aldrich. Material Safety Data Sheet. Sigma-Aldrich. [5 April 2011]. (原始内容存档于2020-11-07).
- ^ 8.0 8.1 Dale L. Perry (1995), "Handbook of Inorganic Compounds (页面存档备份,存于互联网档案馆)", page 167. CRC Press. ISBN 9780849386718
- ^ Stout, J.; Stanley A. Reed. The Crystal Structure of MnF2, FeF2, CoF2, NiF2 and ZnF2. J. Am. Chem. Soc. 1954, 76 (21): 5279–5281. doi:10.1021/ja01650a005.
- ^ M.J.M., de Almeida; M.M.R., Costa; J.A., Paixão. Charge density of FeF2. Acta Crystallographica Section B. 1989-12-01, 45 (6): 549–555. ISSN 0108-7681. doi:10.1107/S0108768189007664 (英语).
- ^ Erickson, R. Neutron Diffraction Studies of Antiferromagnetism in Manganous Fluoride and Some Isomorphous Compounds. Physical Review. June 1953, 90 (5): 779–785. doi:10.1103/PhysRev.90.779.
- ^ Bardi, Gianpiero; Brunetti, Bruno; Piacente, Vincenzo. Vapor Pressure and Standard Enthalpies of Sublimation of Iron Difluoride, Iron Dichloride, and Iron Dibromide. Journal of Chemical & Engineering Data. 1996-01-01, 41 (1): 14–20. ISSN 0021-9568. doi:10.1021/je950115w.
- ^ Kent, Richard; John L. Margrave. Mass Spectrometric Studies at High Temperatures. VIII. The Sublimation Pressure of Iron(II) Fluoride. Journal of the American Chemical Society. November 1965, 87 (21): 4754–4756. doi:10.1021/ja00949a016.
- ^ W. Kwasnik "Iron(II) Fluoride" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 266.
- ^ SOLUBILITY PRODUCT CONSTANTS (PDF). [2022-01-11]. (原始内容 (PDF)存档于2018-07-12).
- ^ Wildermuth, Egon; Stark, Hans; Friedrich, Gabriele; Ebenhöch, Franz Ludwig; Kühborth, Brigitte; Silver, Jack; Rituper, Rafael, Iron Compounds, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a14_591
- ^ Catherine E. Housecroft, A. G. Sharpe: Inorganic chemistry. Prentice Hall, 2004, ISBN 978-0130399137 (氟化亚铁,第622頁,載於Google圖書).
