复分解反应
複分解反应,有時又稱雙置換反應,是一種化學過程,涉及兩種反應化學物質之間的鍵交換,從而產生具有相似或相同鍵合關係的產物[1]。該反應由一般方案表示:
此反应必发生在水溶液中,它是基本类型的化学反应之一。複分解都不是氧化还原反应(有些反应是複分解产物再发生氧化还原,而不是複分解的结果)。
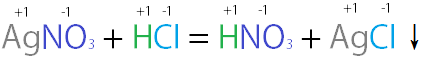
上图是一个复分解反应示例。图中的各种物质组成元素、原子团的化合价在反应前后保持不变。
有机化学中的类似反应为取代反应。
发生条件
编辑
(盐酸除铁锈)
酸加鹼
编辑
概括:酸+碱=盐+水
酸加盐
编辑(实验室制二氧化碳)
概括:酸+盐=新盐+新酸
鹼加鹽
编辑
概括:碱+盐=新盐+新水(反应物均需可溶)
盐加盐
编辑生成物至少有一種沉澱(除非產生氣體)
概括:盐+盐=新盐+新盐(反应物均需可溶)
无机複分解反应
编辑溶液中複分解发生条件:可从设想的生成物而定,如生成物有气体、沉淀、弱电解质、錯合物生成时,则複分解反应一般能进行。即有产物脱离体系时,复分解反应一般能进行。
離子反應
编辑例1:HCl(aq) + KOH(aq) → KCl(aq) + H2O(ℓ)
H+與OH−結合生成弱電解質水,所以反應發生。
H+ + OH− → H2O (H3O+ + OH− → 2 H2O)
K+與Cl−留在溶液中,所以說生成了KCl與H2O。
例2:AgNO3(aq) + HCl(aq) → AgCl(s)↓ + HNO3(aq)
Ag+與Cl−結合生成的AgCl几乎无法溶于水中,以固体形态存在,所以反應發生。
氣體生成
编辑例1:
加熱,溫度升高,沸點低的HCl氣體大部分脫離反應體系,反應發生。
例2:
同上
例3:CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + H2CO3(aq)
首先通過離子反應生成弱電解質H2CO3(強酸制弱酸,但有例外),由于H2CO3极不稳定,分解產生CO2氣體:
烯烃複分解反应
编辑透過研究金屬卡賓在有機化合物生成中所扮演的角式而優化有機化合物的生產過程。由於生產過程中讓金屬擔當催化劑的角色,使這些有機化合物無需要再透過利用卤化過程來達至產品的生成,從而使有機化合物的生產過程可以更環保。伊夫·肖萬、羅伯特·格拉布及理查德·施罗克憑這個研究獲得2005年度諾貝爾化學獎。
参见
编辑参考文献
编辑- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "metathesis"。doi:10.1351/goldbook.M03878.
