卡宾
卡宾(英語:Carbene),又称碳烯[1]、碳宾,是含二价碳的电中性化合物。卡宾是由一个碳和其他两个基团以共价键结合形成的,碳上还有两个自由电子。最简单的卡宾是亚甲基卡宾,亚甲基卡宾很不稳定,从未分离出来,是比碳正离子、自由基更不稳定的活性中间体。其他卡宾可以看作是取代亚甲基卡宾,取代基可以是烷基、芳基、酰基、卤素等。这些卡宾的稳定性顺序排列如下:
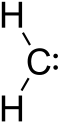
氮杂环卡宾是一类较新颖的卡宾,也译作稳定卡宾,具有特殊的稳定性,有些可以无限期的保存。典型的氮杂环卡宾中,卡宾的二价碳位于咪唑、噻唑、1,2,4-三嗪环系或与两个取代氨基相连的碳上。
结构
编辑卡宾有两种结构,在光谱学上分别称为单线态和三线态。单线态卡宾中,中心碳原子是sp2杂化,有一对孤对电子;三线态卡宾有两个自由电子,可以是sp2或直线形的sp杂化。除了二卤卡宾和与氮、氧、硫原子相连的卡宾,大多数的卡宾都处于非直线形的三线态基态。
卡宾是单线态还是三线态由其电子自旋决定。三线态卡宾为顺磁性,寿命足够长的话可以被电子自旋共振谱(EPR or ESR)检测到。单线态卡宾的总自旋为0,三线态的总自旋为1(单位 ),三线态亚甲基卡宾的键角为125-140°,相应的单线态卡宾为102°。一般地讲,气态时三线态卡宾更加稳定,单线态卡宾在溶液中更加稳定。
对于简单的烃基卡宾而言,三线态卡宾的能量一般比单线态卡宾低33kJ/mol(洪特最大多重度规则),因此基态时三线态更稳定,激发态时单线态更加稳定。单线态卡宾形成后,与反应器壁或其他分子碰撞,会逐渐转化为三线态卡宾。某些给电子的取代基会向单线态卡宾的空p轨道贡献电子,从而增加了其稳定性,有可能使单线态的能量低于三线态,成为基态主要形式。然而,可以增加三线态卡宾稳定性的方法很少。电脑模拟的实验显示电正性的基团(如三氟硅基)对三线态的稳定性有一定程度的贡献。[2]
某些卡宾,如9-亚芴基卡宾,其单线态与三线态的能量差异只有4.6kJ/mol,通常是两种形式的平衡体系。[3]有些人认为电子在这类二芳基卡宾中离域范围太广,它们实际上不能算作卡宾,而是属于双自由基的范畴。
反应
编辑卡宾的反应性与取代基的性质、制备方法、反应条件(金属的存在)等因素有很大关系,三线态卡宾和单线态卡宾的反应性也不相同。三线态卡宾有两个自由电子,自旋平行,反应时更类似于双自由基,另一个电子不能立即成键,因此三线态卡宾参与的自由基加成反应较多。单线态卡宾两个电子自旋相反,反应为协同反应,因此与烯烃加成产物的立体专一性比三线态卡宾更强,可用来区别这二者。单线态卡宾在螯变反应中可以是亲电试剂或亲核试剂。
单线态亚甲基卡宾的反应比三线态亚甲基卡宾更具立体专一性。重氮甲烷在液态光解生成的卡宾是单线态卡宾,与烯烃发生立体专一的顺式加成;但在光敏剂二苯酮存在下光照重氮甲烷,会得到三线态卡宾,与烯烃加成先发生一个电子的成键,另一个电子需要等到由于碰撞使其改变自旋方向时才可以成键,因此反应产物是顺式和反式的混合物。[4]
插入反应是卡宾的一类很重要的反应,主要分为对C-H键的插入、对双键的加成以及反应物结构的重排。这里卡宾的性质可分类为亲核、亲电或兼有以上两者,受取代基的影响很大,例如,若卡宾与给电子取代基相连,则该卡宾的亲电性也会相应降低。单线态亚甲基卡宾的插入反应选择性很低,无法分辨一级、二级和三级C-H键,反应基本上是按统计比例进行。相比之下,烷基卡宾和三线态亚甲基卡宾的选择性更强。
卡宾可与双键加成生成环丙烷的衍生物。单线态卡宾的加成产物有立体专一性,与三线态卡宾相区别。加成反应放热,速率很快。一般反应的决速步是卡宾的生成反应,卡宾一旦生成,就与底物立即发生反应。此类反应中的卡宾常用類碳烯(有机锌化合物,西蒙斯–史密斯反應,ICH2ZnI),与卡宾起到一样的作用,反应是立体专一的顺式加成,虽然产率不太高,但很难用其他方法代替。
氯化亚铜或溴化亚铜催化下,苯与重氮甲烷分解出的亚甲基卡宾(非游离态)加成,经由一个环己二烯并三元环的中间体,反应物重排扩环,可以得到85%产率的环庚三烯。用二卤卡宾与烯烃加成时,产物偕二卤代碳可以发生水解,生成环丙酮的衍生物。
卡宾插入C-H键时,在C-H键中插入碳原子,反应的优先顺序一般是:
- X-H键,X是杂原子;
- C-H键;
- C-C键。
通过引入含金属的手性配体,有些插入反应(分子内或分子间)可以生成不对称的产物。
分子内的卡宾插入反应也是有机合成路线之一。一般反应在有张力或位阻的反应物上发生,比分子间插入优先进行,并且生成五元环的反应比六元环更容易进行。
亚烷基卡宾由酮与三甲基硅基重氮甲烷反应得到,可用于构建环戊烯环系:
有机金属化学
编辑卡宾可与金属成键而得到稳定,是过渡金属卡宾配合物的研究内容,包括以下几种:
制取
编辑参见
编辑参考资料
编辑- ^ carbene - 碳烯;亞甲體{中間體}. 國家教育研究院雙語詞彙、學術名詞暨辭書資訊網.
- ^ Nemirowski, Adelina; Schreiner, Peter R. Electronic Stabilization of Ground State Triplet Carbenes. The Journal of Organic Chemistry. 2007-12-01, 72 (25): 9533–9540 [2022-03-05]. ISSN 0022-3263. doi:10.1021/jo701615x. (原始内容存档于2022-03-05) (英语).
- ^ Grasse, P. B.; Brauer, B.-E.; Zupancic, J. J.; Kaufmann, K. J.; Schuster, G. B. ChemInform Abstract: CHEMICAL AND PHYSICAL PROPERTIES OF FLUORENYLIDENE: EQUILIBRATION OF THE SINGLET AND TRIPLET CARBENES. Chemischer Informationsdienst. 1984-02-14, 15 (7) [2022-03-05]. doi:10.1002/chin.198407113. (原始内容存档于2022-03-05) (英语).
- ^ Skell, Philip S.; Woodworth, Robert C. STRUCTURE OF CARBENE, CH 2. Journal of the American Chemical Society. 1956-09, 78 (17): 4496–4497 [2022-03-05]. ISSN 0002-7863. doi:10.1021/ja01598a087. (原始内容存档于2022-03-05) (英语).
參考文獻
编辑- 邢其毅等.《基础有机化学》第三版上册.北京:高等教育出版社,2005年.ISBN 7-04-016637-2.